Farmacología

Ataluren para Duchenne: cómo la política y la presión social minaron las decisiones basadas en la evidencia
17 diciembre 2025
Los autores concluyen que el caso de ataluren constituye un ejemplo paradigmático de los riesgos asociados a aprobar y mantener en el mercado medicamentos huérfanos sin evidencia sólida de beneficio clínico. Subrayan la necesidad de reforzar la independencia regulatoria, exigir ensayos confirmatorios rigurosos y oportunos, promover estudios independientes y registros de pacientes, y proteger los sistemas de salud de decisiones influenciadas por expectativas infundadas, presión social o intereses políticos, en detrimento de la equidad, la sostenibilidad y la medicina basada en la evidencia. BMJ Evidence-Based Medicine, 13 de diciembre de 2025

Datos del mundo real y evidencia del mundo real en la toma de decisiones regulatorias: Resumen del informe del Grupo de trabajo XIII del Consejo de Organizaciones Internacionales de Ciencias Médicas (CIOMS)
28 abril 2025
Un informe reciente de un grupo de trabajo del Consejo de Organizaciones Internacionales de las Ciencias Médicas (CIOMS) describe el uso de la evidencia del mundo real (RWE) para la toma de decisiones en el ciclo de vida de los productos médicos, describe los datos del mundo real (RWD) y las fuentes de datos, analiza las consideraciones científicas clave en la generación de la RWE y aborda los aspectos éticos y de gobernanza relacionados con su uso. Pharmacoepidemiol Drug Saf. marzo de 2025

Duración de la revisión regulatoria y diferencias en los tiempos de presentación de medicamentos en Estados Unidos y Europa, 2011 a 2020
17 octubre 2023
Sería beneficioso para los pacientes si se siguieran minimizando las diferencias en los tiempos de presentación entre Estados Unidos y Europa. Ann Intern Med. 17 de octubre de 2023
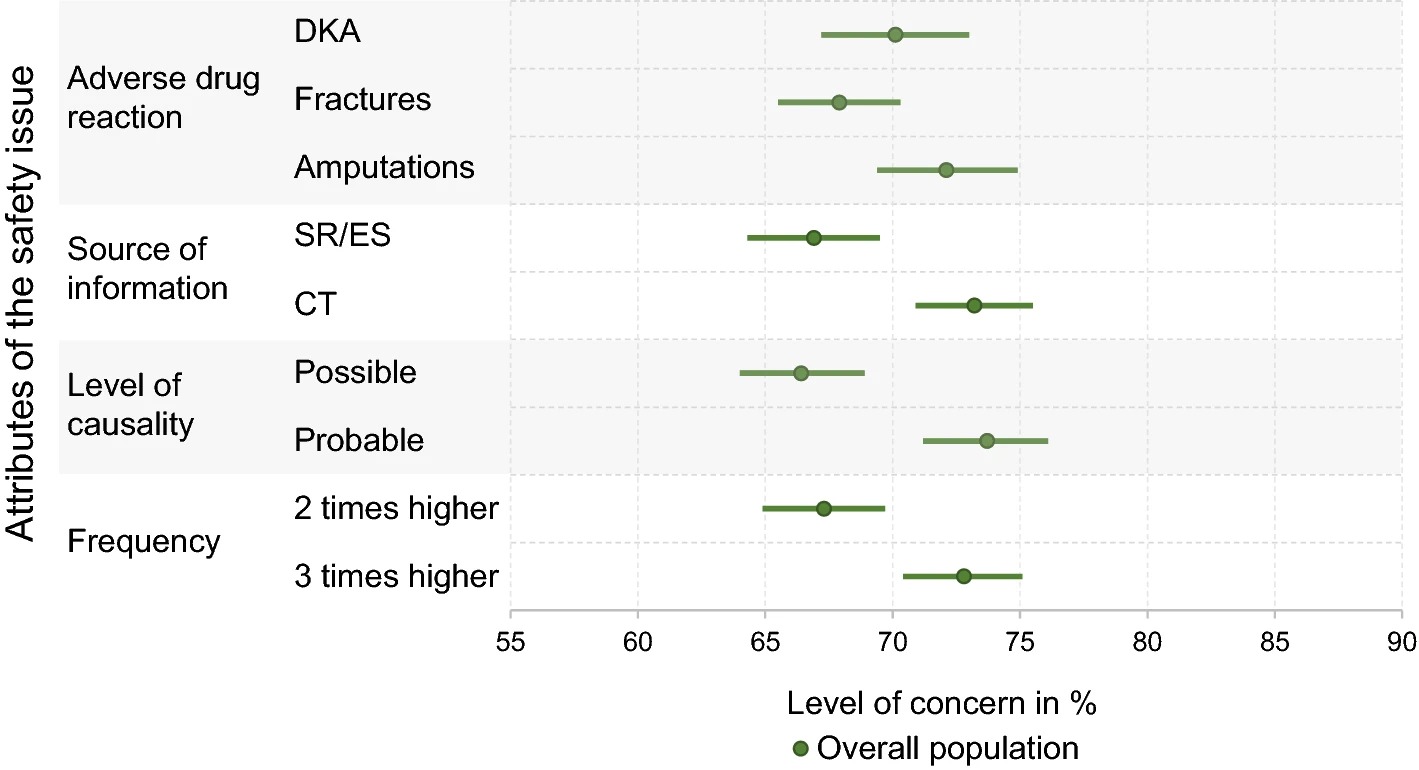
La base de evidencia de las aprobaciones de nuevas terapias contra el cáncer por la FDA, de 2000 a 2020
17 febrero 2023
Durante 21 años, los nuevos medicamentos contra el cáncer generalmente se han aprobado en función de un solo ensayo clínico, a menudo no controlado, que mide criterios de valoración alternativos. Esto deja a los pacientes con cáncer sin pruebas sólidas de que los nuevos fármacos mejoren su supervivencia o calidad de vida y no hay indicios de mejora. Int J Cáncer. 13 de febrero de 2023

Evaluación de medicamentos aprobados por la FDA no recomendados en otros países para su uso o reembolso , 2017-2020
14 febrero 2023
