Farmacología

Características, beneficio clínico y financiación de las nuevas autorizaciones de fármacos oncohematológicos en España entre 2017 y 2020
04 febrero 2025
la mayoría de los ensayos clínicos pivotales de nuevos fármacos oncohematológicos autorizados en España emplearon variables principales subrogadas y, en el momento de la autorización, pocos habían demostrado prolongar la supervivencia. Más de un tercio eran ensayos clínicos no controlados. Farm Hosp. 2024

Evaluación del riesgo, el beneficio y los resultados del paciente en el desarrollo de fármacos: estudio observacional de ensayos clínicos de regorafenib
25 marzo 2024
Los ensayos sobre el cáncer colorrectal comenzaron siendo positivos, pero con el tiempo se volvieron más negativos. El riesgo acumulativo para los pacientes aumentó con el tiempo, mientras que la tasa de respuesta objetiva se mantuvo constantemente baja.Los hallazgos sugieren que desde la aprobación original de regorafenib por la Administración de Alimentos y Medicamentos (FDA), el perfil de riesgo para su indicación original aumentó. La cantidad de ensayos no aleatorios de un solo grupo en el tamaño de nuestra muestra fue preocupante, lo que indica que se debe realizar una investigación de mayor calidad. BMJ Oncology, marzo de 2024

Qué impulsa la acumulación de ensayos clínicos de cáncer? Un análisis empírico de los estudios que condujeron a la autorización de la FDA (2015-2020)
12 octubre 2022
En este estudio transversal, la línea de terapia, la fase de estudio y el fabricante fueron los únicos factores asociados con la tasa de acumulación. Estos hallazgos sugieren que muchos factores propuestos para la rápida acumulación de ensayos no están asociados con mayores tasas de inscripción. BMJ Open, 7 de octubre de 2022
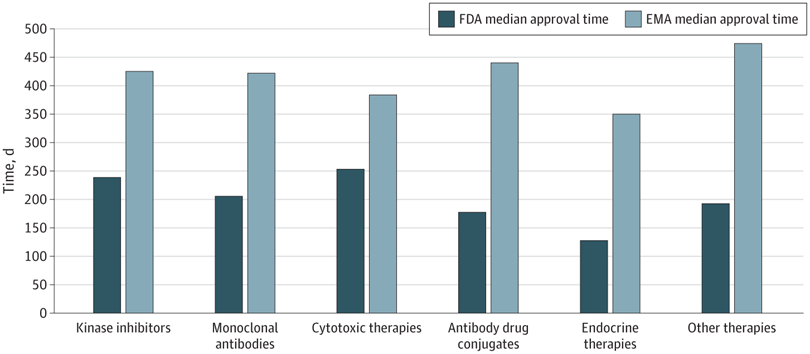
Plazos de aprobación de la terapia del cáncer, velocidad de revisión y publicación de ensayos de registro pivotales en los EE. UU. y Europa, 2010-2019
16 junio 2022
En este estudio transversal, las nuevas terapias oncológicas se aprobaron antes en EE. UU. que en Europa. La FDA recibió las solicitudes de licencia antes y tuvo tiempos de revisión más cortos. Sin embargo, se aprobaron más terapias antes de la publicación del estudio pivotal, lo que genera incertidumbre para los profesionales con respecto a la utilidad clínica y la seguridad de las terapias recientemente aprobadas. JAMA Netw Open. 10 de junio de 2022
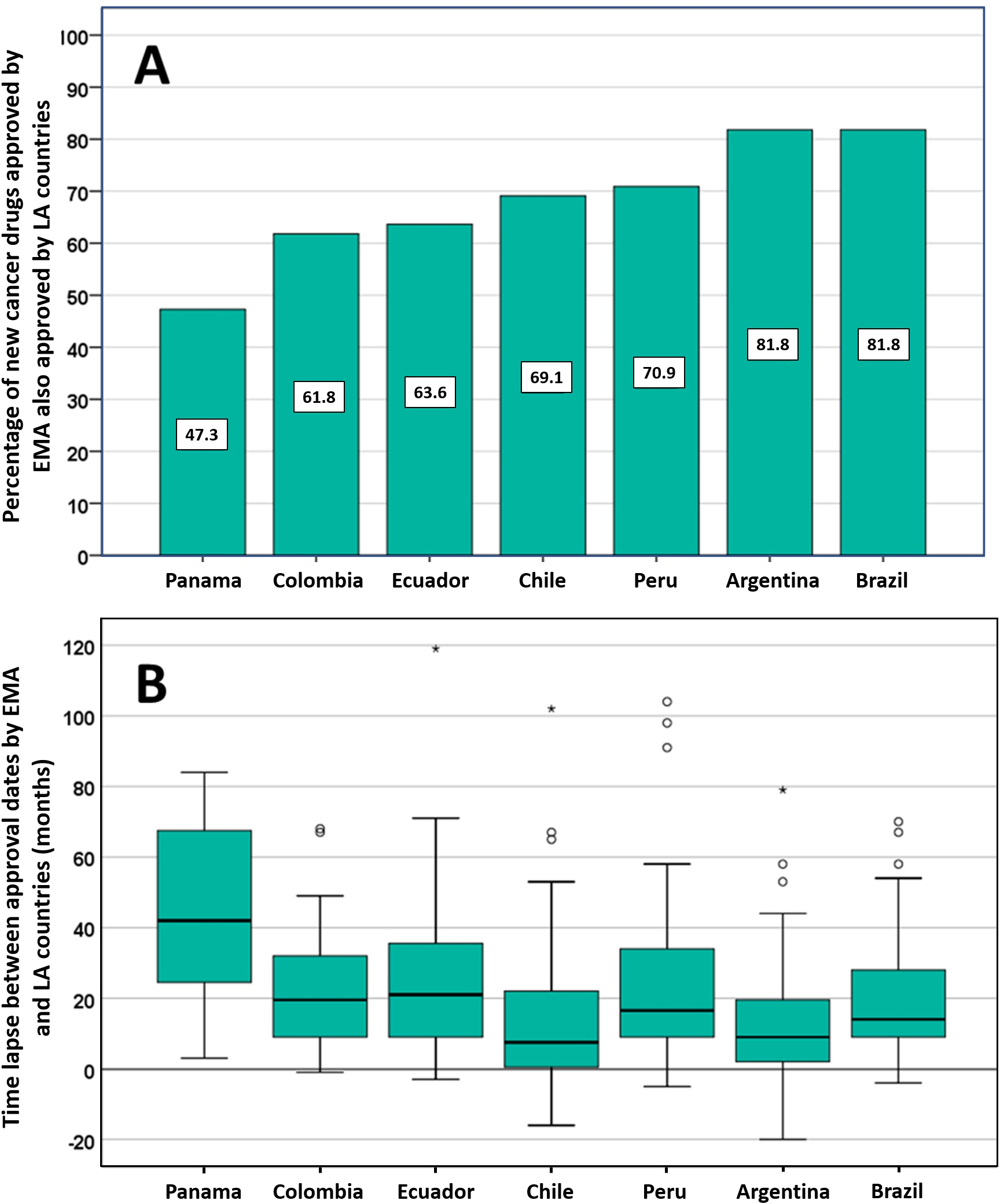
Posible impacto negativo de las decisiones de Agencias reguladoras reputadas sobre el estado de aprobación de nuevos medicamentos contra el cáncer en los países de América Latina
14 julio 2021
