Farmacología

Evaluación de las consecuencias de los precios de referencia externos para el acceso mundial a los medicamentos y la innovación
11 abril 2022
esta investigación proporciona información clave sobre las posibles consecuencias no intencionales de la fijación de precios de medicamentos por parte de precios de referencia externa (ERP) en todo el mundo y bajo una nueva propuesta para los Estados Unidos. Nuestros resultados pueden informar las discusiones de las partes interesadas para mejorar el acceso de los pacientes a medicamentos innovadores a nivel mundial. Front. Pharmacol., 6 de abril de 2022
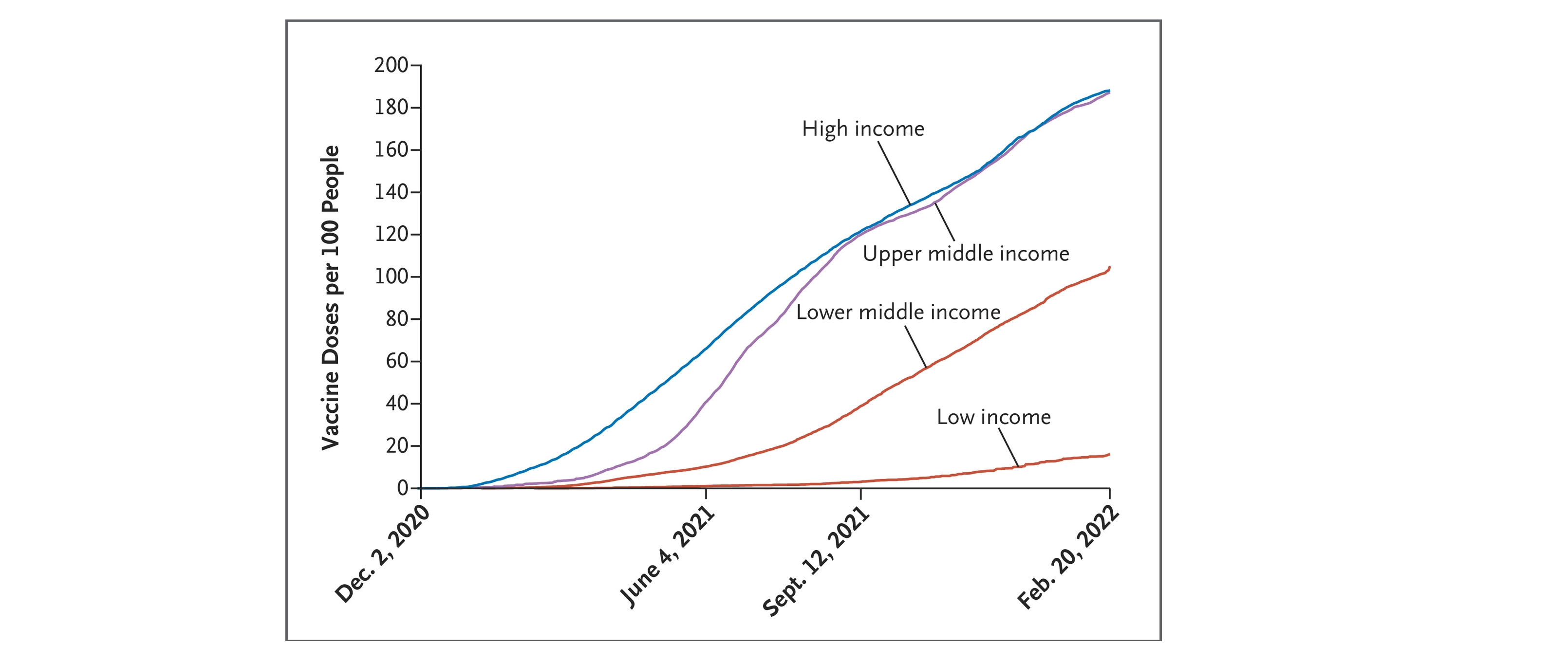
Inequidad global en el acceso a las vacunas contra Covid-19
25 febrero 2022
Este editorial afirma que las vacunas contra las enfermedades pandémicas y la capacidad de fabricarlas no deben ser un activo secuestrado, destinado a maximizar el rendimiento de los ejecutivos y accionistas de las compañías farmacéuticas o a aumentar la elegibilidad de los políticos. Deben ser un bien público mundial. New England Journal of Medicine, 23 de febrero de 2022.
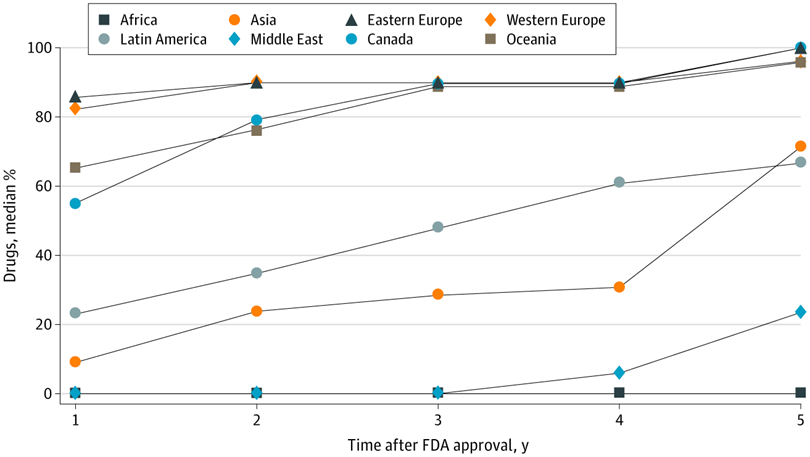
Evaluación de ensayos de medicamentos en países de ingresos altos, medianos y bajos y disponibilidad comercial local de medicamentos recientemente aprobados
17 mayo 2021
Estos hallazgos sugieren que existen brechas sustanciales entre dónde se prueban los medicamentos aprobados por la FDA y dónde finalmente están disponibles para los pacientes, lo que genera inquietudes sobre la distribución equitativa de los beneficios de la investigación a nivel de la población. JAMA Netw Open. 5 de mayo de 2021

Las metas de inmunización y los precios de las vacunas Covid-19 presionarán en exceso los presupuestos de los países de América Latina.
04 septiembre 2020
Se estimo el presupuesto que 9 países de la región de Latinoamérica necesitarian para vacunar grupos en riesgo si se pagaran los precios declarados por Moderna o Pfizer. Sin duda, vacunas a estos precios serían inasequibles para los sistemas de salud de la región. Boletín DIME #22 31 de agosto de 2020

Precios justos: 4) El precio de los medicamentos se está convirtiendo en un gran desafío para los sistemas de salud.
16 enero 2020
