Farmacología

Ácido obeticólico (Ocaliva) información de la AEMPS : el CHMP recomienda la revocación de la autorización de comercialización
02 julio 2024
Una revisión de los datos disponibles ha concluido que no se ha confirmado la eficacia del ácido obeticólico , utilizado para tratar la colangitis biliar primaria (CBP). El estudio 747-302 no ha mostrado diferencias entre ácido obeticólico y placebo en la variable primaria compuesta de muerte, trasplante hepático o descompensación hepática en pacientes con CBP que no responden o son intolerantes al ácido ursodesoxicólico (HR 1,01 [IC 95%: 0,68; 1,51], valor p: 0,954). El Comité de Medicamentos de Uso Humano (CHMP, por sus siglas en inglés) ha recomendado la revocación de la autorización de ácido obeticólico (Ocaliva) en la UE porque se considera que sus beneficios no superan los riesgos. AEMPS, 1 de julio de 2024

Regulación de la venta de productos médicos por Internet: experiencias y estrategias para Latinoamérica
19 mayo 2023
A partir de esta revisión, se proponen las siguientes líneas estratégicas: fortalecimiento del marco regulatorio y normativo; fortalecimiento de la capacidad fiscalizadora; colaboración con autoridades y otros actores clave nacionales e internacionales; y comunicación y sensibilización con la comunidad y los profesionales de salud. Cada una de estas estrategias deben ir acompañadas con acciones específicas, que pueden servir como orientaciones para las ARN de las Américas, y de países con contextos similares para el fortalecimiento de sus marcos regulatorios y la protección de los pacientes y consumidores. Rev Panam Salud Publica. 16 de mayo de 2023
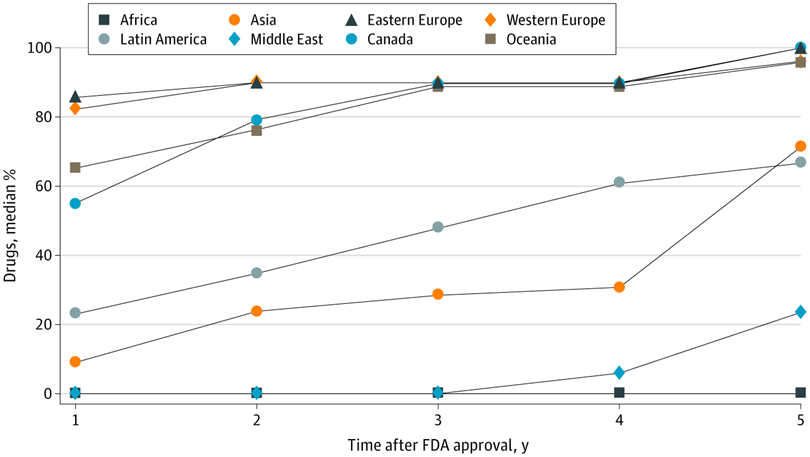
Evaluación de ensayos de medicamentos en países de ingresos altos, medianos y bajos y disponibilidad comercial local de medicamentos recientemente aprobados
17 mayo 2021
Estos hallazgos sugieren que existen brechas sustanciales entre dónde se prueban los medicamentos aprobados por la FDA y dónde finalmente están disponibles para los pacientes, lo que genera inquietudes sobre la distribución equitativa de los beneficios de la investigación a nivel de la población. JAMA Netw Open. 5 de mayo de 2021

La agencia europea rechaza la autorización de romosozumab
02 julio 2019
El nuevo anticuerpo monoclonal para osteoporosis produjo aumento de eventos cardiovasculares y de la mortalidad en mayores de 75 años. EMA, 28 de junio de 2019

Obstáculos para el acceso a nuevos medicamentos: búsqueda del equilibrio entre los costos crecientes y los presupuestos limitados
10 diciembre 2018
