Farmacología

Características, beneficio clínico y financiación de las nuevas autorizaciones de fármacos oncohematológicos en España entre 2017 y 2020
04 febrero 2025
la mayoría de los ensayos clínicos pivotales de nuevos fármacos oncohematológicos autorizados en España emplearon variables principales subrogadas y, en el momento de la autorización, pocos habían demostrado prolongar la supervivencia. Más de un tercio eran ensayos clínicos no controlados. Farm Hosp. 2024

La ANMAT habilitó criterios “excepcionales” para aumentar el volumen de repelentes
27 noviembre 2024
Ante la inminente llegada del verano y para que los repelentes de insectos, principalmente para los mosquitos, sean de más fácil acceso a toda la población, la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica estableció “criterios extraordinarios y temporales” para tabletas y líquidos para atenuar el ataque de los mosquitos y el dengue, hasta el 31 de marzo del 2025. Anmat , 26 de noviembre de 2024
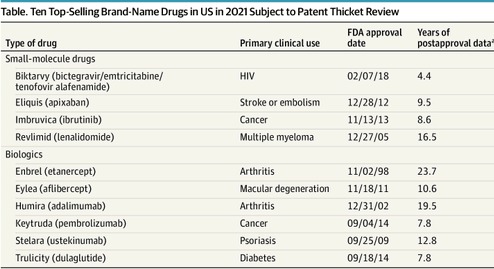
Carteras de patentes que protegen los 10 medicamentos de venta bajo receta más vendidos
14 mayo 2024
Este estudio encontró que de las 1429 patentes solicitadas para los 10 medicamentos recetados más vendidos en los EE. UU. en 2021, las presentadas después de la aprobación de la FDA (casi las tres cuartas partes) y que contenían reivindicaciones que cubrían aspectos distintos del ingrediente activo del medicamento contribuyeron a la maraña de patentes. Es necesario un examen minucioso de las solicitudes de patentes y de las patentes presentadas después de la aprobación de la FDA para facilitar la competencia oportuna de genéricos o biosimilares. JAMA Intern Med. 13 de mayo de 2024.

Evaluación del riesgo, el beneficio y los resultados del paciente en el desarrollo de fármacos: estudio observacional de ensayos clínicos de regorafenib
25 marzo 2024
Los ensayos sobre el cáncer colorrectal comenzaron siendo positivos, pero con el tiempo se volvieron más negativos. El riesgo acumulativo para los pacientes aumentó con el tiempo, mientras que la tasa de respuesta objetiva se mantuvo constantemente baja.Los hallazgos sugieren que desde la aprobación original de regorafenib por la Administración de Alimentos y Medicamentos (FDA), el perfil de riesgo para su indicación original aumentó. La cantidad de ensayos no aleatorios de un solo grupo en el tamaño de nuestra muestra fue preocupante, lo que indica que se debe realizar una investigación de mayor calidad. BMJ Oncology, marzo de 2024

Tiempo de revisión de los medicamentos oncológicos y sus factores subyacentes: una exploración en China
06 noviembre 2023
