Farmacología
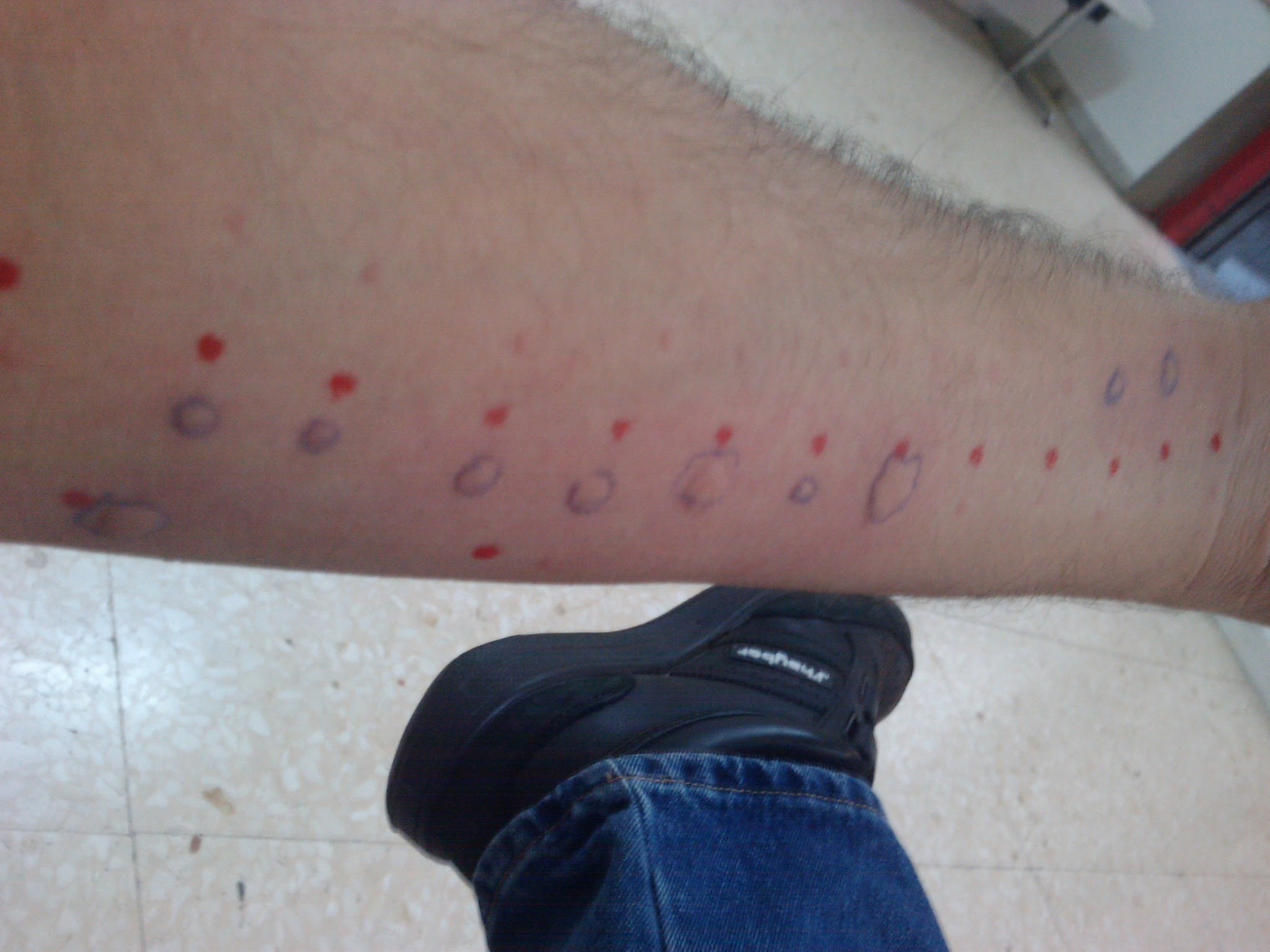
Opciones terapéuticas tras reacciones de hipersensibilidad a la quimioterapia: el valor de las pruebas cutáneas
14 agosto 2025
Este estudio confirma la relevancia de las reacciones adversas para ayudar a los oncólogos a orientar las estrategias de tratamiento tras una presunta alergia. Como parte de la evaluación alergológica, las reacciones adversas ayudan a prevenir cambios innecesarios en las líneas de quimioterapia en pacientes con alergias no comprobadas y facilitan la identificación de tratamientos alternativos tras las reacciones adversas de alta sensibilidad. European Journal of Hospital Pharmacy, julio de 2025.

La paradoja de la futilidad terapéutica: perspectivas desde la litigación de medicamentos oncológicos en Ecuador
10 abril 2025
Estos hallazgos revelan discrepancias significativas entre la evidencia científica disponible y los argumentos que sustentan las decisiones judiciales en casos de acceso a medicamentos oncológicos en Ecuador. Frontiers in Medicine, 13 de marzo de 2025

Tiempo hasta la aprobación total o el retiro de medicamentos contra el cáncer que recibieron aprobación acelerada por parte de la FDA
09 abril 2025
Este estudio de cohorte de 102 indicaciones de medicamentos oncológicos aprobados en forma acelerada entre 1992 y 2022 y que se convirtieron en aprobación regular para agosto de 2024, el bajo beneficio clínico o las preocupaciones de seguridad en la aprobación acelerada se asociaron con un retraso en la aprobación regular, lo que debería ser una señal de precaución para los pacientes y oncólogos que consideren su uso. JAMANetwork Open, 26 de marzo de 2025.

Evidencias poscomercialización de medicamentos contra el cáncer en la toma de decisiones clínicas y regulatorias: revisión exploratoria
06 febrero 2025
En general, estos hallazgos plantean preguntas importantes en torno a la disponibilidad, accesibilidad y evaluación de la evidencia posterior a la comercialización sobre los beneficios y daños de los medicamentos contra el cáncer, de modo que puedan ser utilizados por los profesionales de la salud que trabajan en servicios oncológicos y por las personas con cáncer. Pharmacoepidemiol Drug Saf. enero de 2025

Características, beneficio clínico y financiación de las nuevas autorizaciones de fármacos oncohematológicos en España entre 2017 y 2020
04 febrero 2025
