Farmacología

Idelalisib: de la aprobación acelerada al retiro de indicaciones por toxicidad
23 marzo 2023
FDA lo aprobó por vía acelerada en 2014, para recidivas de leucemia linfocítica crónica, linfoma no Hodgkin folicular de células B y linfoma linfocítico pequeño. En 2016 los estudios postcomercialización ya mostraban aumento de efectos adversos graves y de la mortalidad, pero la venta del medicamento continuó. Recién en 2022 el laboratorio retiró en forma voluntaria la indicación para las dos últimas patologías señaladas. Es necesario prestar más atención a la eficacia y seguridadde los medicamentos que llegan al mercado mediante una aprobación acelerada. JAMA Internal Medicine, 20 de marzo de 2023.

Modernización de la vía de aprobación acelerada de la FDA de EE. UU.
02 marzo 2023
Dado que la Aprobación Acelerada se usa predominantemente en oncología, con medicamentos contra el cáncer que representan el 85% del uso durante la última década, las reformas son muy relevantes para el desarrollo y la aprobación de nuevos medicamentos contra el cáncer. Por lo tanto, destacaremos las reformas clave y las posibles oportunidades y desafíos que podrían presentar. Lancet Oncol, 1 de marzo de 2023

Aprobación acelerada: relación entre el momento de inicio de las pruebas confirmatorias y la aprobación final
31 enero 2023
Las indicaciones con aprobación acelerada entre 2002 y 2018 que tenían ensayos de confirmación iniciados antes de la aprobación tuvieron una conversión más rápida a la aprobación o retiro tradicional que aquellas que no lo hicieron, lo que redujo la duración de la exposición del paciente a terapias con eficacia incierta. JAMA, 27 de enero de 2023.

Dificultades de la FDA para retirar un fármaco aprobado por vía acelerada
12 diciembre 2022
A pesar de que los ensayos clínicos del caproato de hidroxiprogresterona para prevención del parto prematuro no mostraron eficacia en desenlaces clínicos relevantes, la decisión de la FDA de revocar la autorización por vía acelerada de este medicamento se encuentra con la resistencia del productor, que ha conseguido eludir hasta ahora el cumplimiento de la medida. Este caso señala una debilidad adicional del sistema de aprobación acelerada de la FDA y permite que se siga comercializando un fármaco cuya falta de utilidad ha quedado probada. JAMA, 8 de diciembre de 2022.
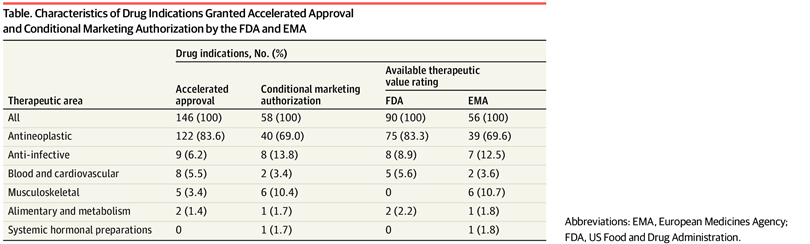
Valor terapéutico de los medicamentos con aprobación acelerada o autorización de comercialización condicional en los EE. UU. y Europa de 2007 a 2021
23 agosto 2022
