Farmacología

Información regional y global consolidada sobre ESAVI contra la covid-19. Actualización 22 de octubre de 2021
02 noviembre 2021
Vigésimo octavo informe, Organización Panamericana de la Salud, 30 de octubre de 2021

Administración de dosis adicional al esquema primario de vacunación contra COVID-19: Memorandúm y Guía
27 octubre 2021
El Ministerio de Salud de la Nación comunica: La recomendación sobre aplicación de una dosis adicional en dos grupos de población definidos: - Personas con inmunocompromiso que hayan recibido un esquema primario con cualquier vacuna contra la COVID-19.- Personas de 50 años o mayores que hayan recibido un esquema primario de vacuna a virus inactivado. Ministerio de Salud de la Nación, 26 y 27 de octubre de 2021.

La OMS recomienda una vacuna contra la malaria para los niños del África subsahariana
19 octubre 2021
Para una enfermedad que genera más de 400.000 muertes anuales, esta vacuna que muestra una eficacia modesta del 30% podría tener un efecto considerable en la mejora de la supervivencia infantil. La amplia disponibilidad de la inmunización contra la malaria significará que la perspectiva de poner fin a la mortalidad infantil evitable en una generación está ahora un paso más cerca. The Lancet, 16 de octubre de 2021.
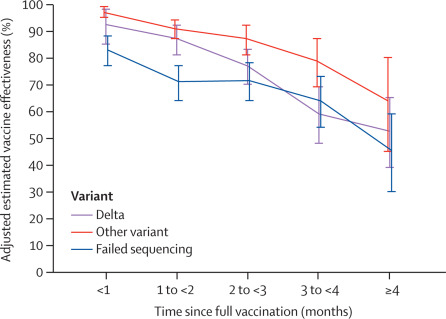
Efectividad de la vacuna ARNm BNT162b2 COVID-19 hasta 6 meses en un gran sistema de salud integrado en los EE. UU .: un estudio de cohorte retrospectivo
05 octubre 2021
Nuestros resultados apoyan la alta efectividad de BNT162b2 contra los ingresos hospitalarios hasta aproximadamente 6 meses después de haber sido completamente vacunado, incluso frente a la diseminación generalizada de la variante delta. La reducción de la eficacia de la vacuna contra las infecciones por SARS-CoV-2 a lo largo del tiempo probablemente se deba principalmente a la disminución de la inmunidad con el tiempo más que a la variante delta que escapa a la protección de la vacuna. Lancet, 4 de octubre de 2021

Recomendaciones de la EMA sobre terceras dosis y dosis de refuerzo de las vacunas frente a la COVID-19 Comirnaty (BioNTech/Pfizer) y Spikevax (Moderna)
05 octubre 2021
