Farmacología
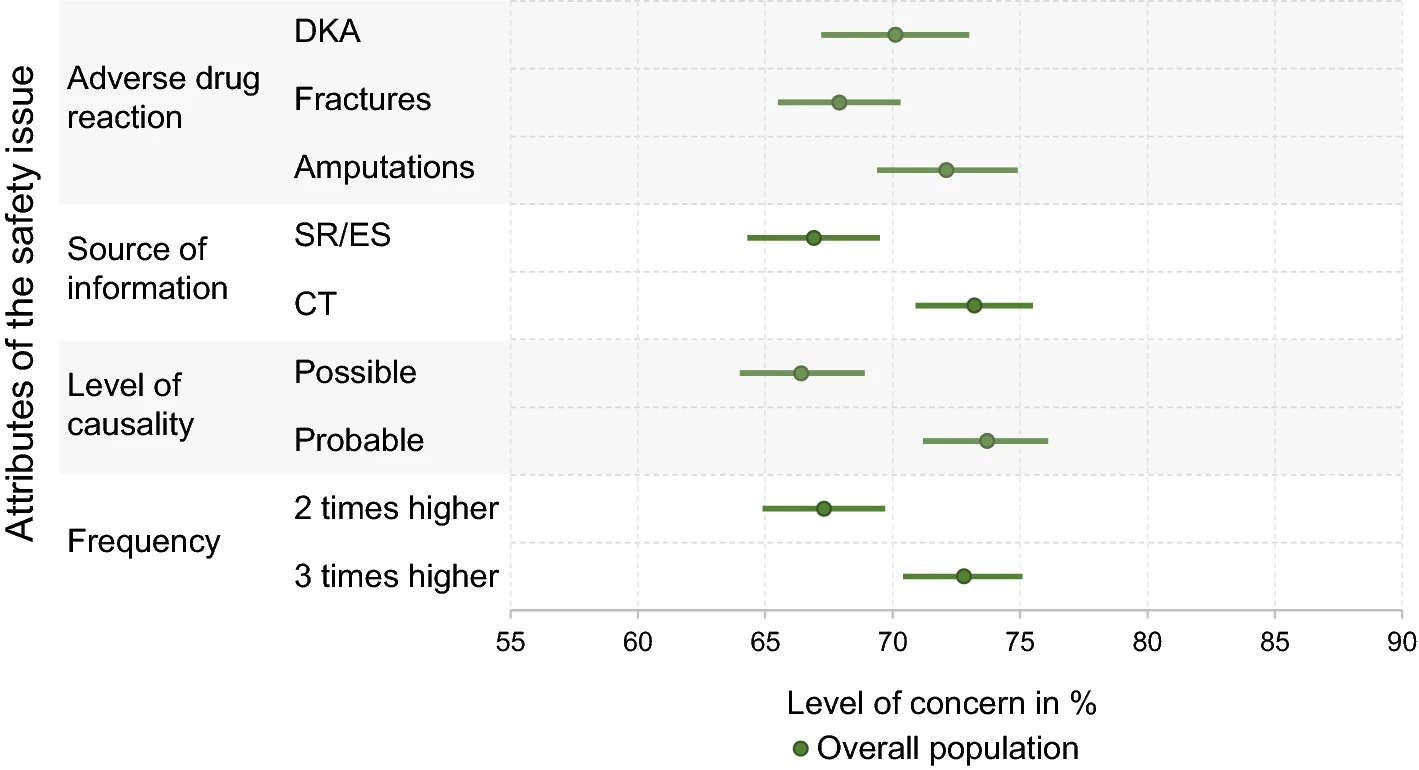
La base de evidencia de las aprobaciones de nuevas terapias contra el cáncer por la FDA, de 2000 a 2020
17 febrero 2023
Durante 21 años, los nuevos medicamentos contra el cáncer generalmente se han aprobado en función de un solo ensayo clínico, a menudo no controlado, que mide criterios de valoración alternativos. Esto deja a los pacientes con cáncer sin pruebas sólidas de que los nuevos fármacos mejoren su supervivencia o calidad de vida y no hay indicios de mejora. Int J Cáncer. 13 de febrero de 2023
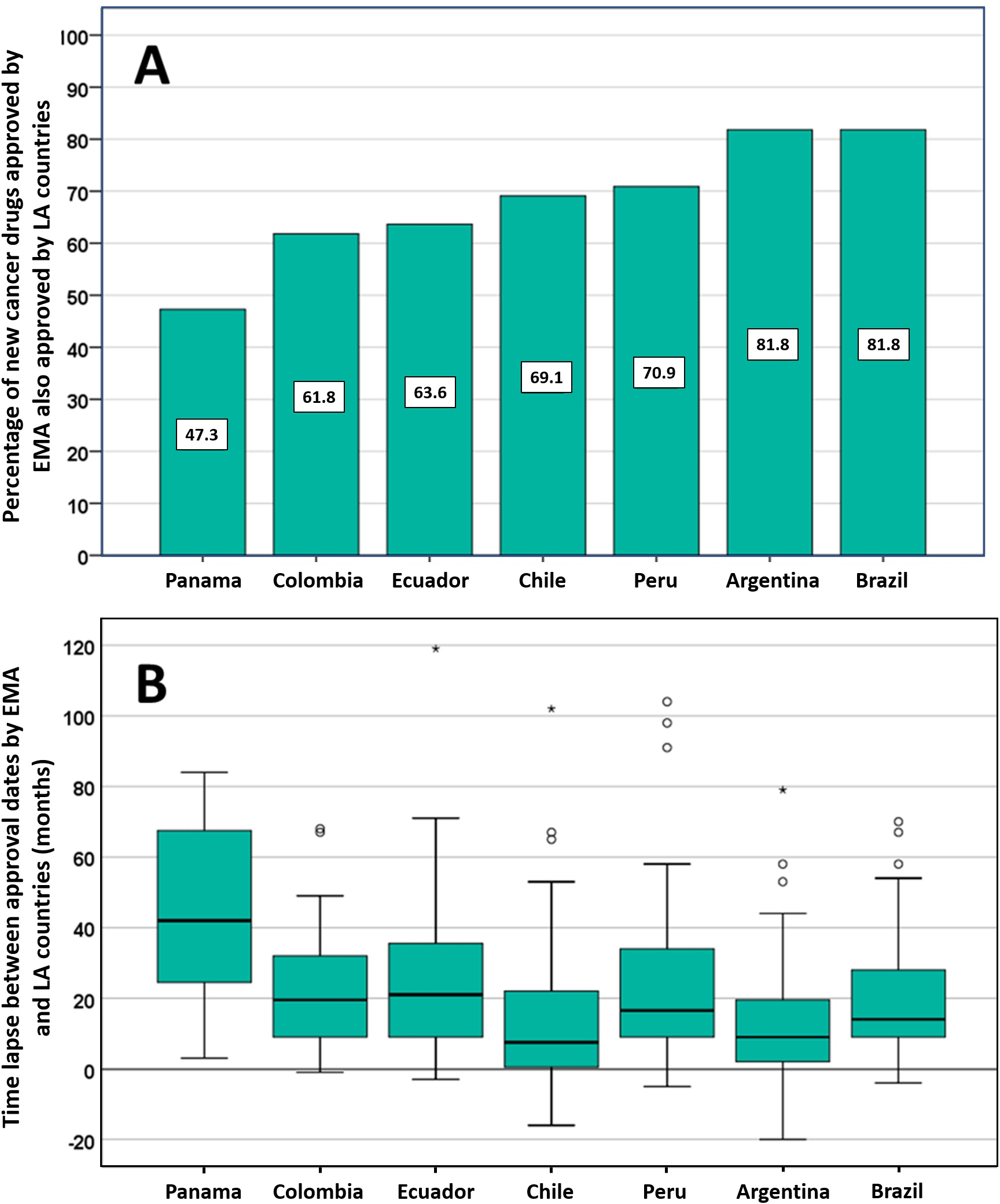
Posible impacto negativo de las decisiones de Agencias reguladoras reputadas sobre el estado de aprobación de nuevos medicamentos contra el cáncer en los países de América Latina
14 julio 2021
Los países de América Latina siguen aprobando nuevos medicamentos contra el cáncer, a menudo basándose en ensayos clínicos mal realizados que miden criterios de valoración sustitutos. La EMA y otros reguladores de renombre deben ser conscientes de que sus decisiones regulatorias pueden influir directamente en las decisiones relativas a la autorización de comercialización, los presupuestos de salud y la atención del paciente en otros lugares. PLoS ONE 13 de julio de 2021
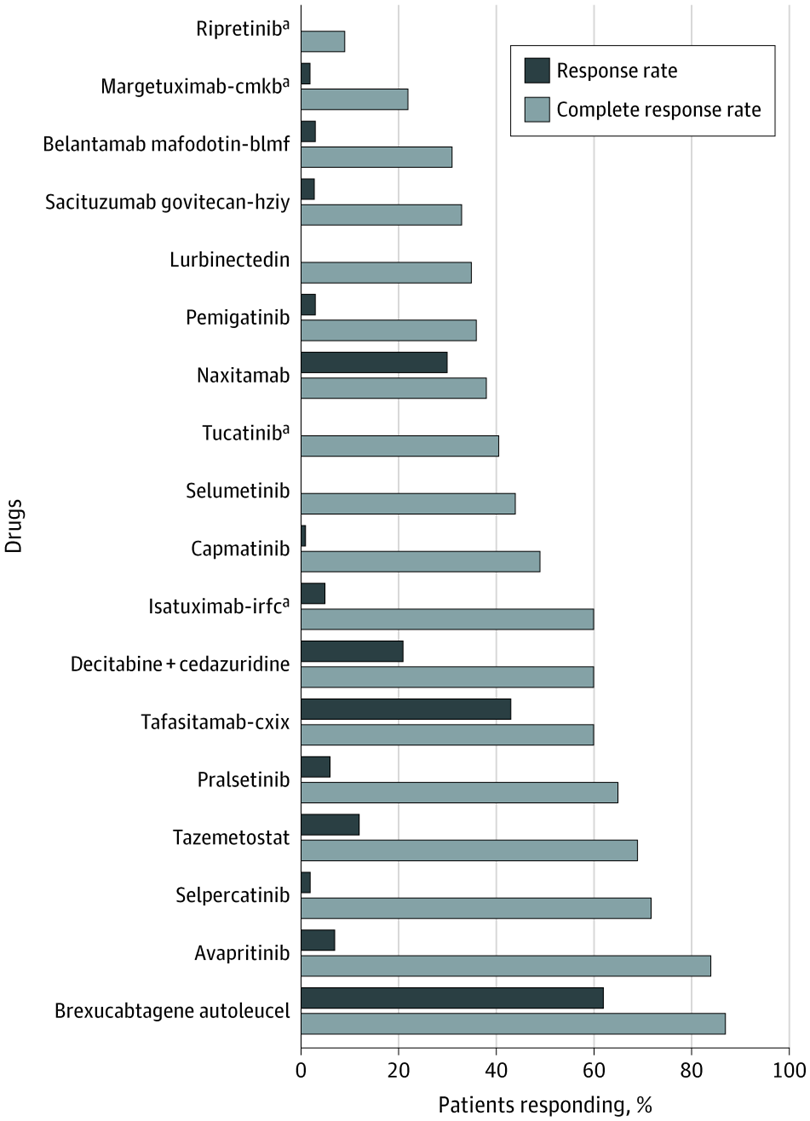
Evaluación de nuevas entidades moleculares aprobadas para el tratamiento del cáncer en 2020
02 junio 2021
La FDA aprobó más nuevas entidades moleculares (NEM) para el cáncer en 2020 que en 2019. Sin embargo, la mayoría de las NEM aprobadas se basaron en criterios de valoración sustitutos con efectos inciertos sobre la supervivencia y la calidad de vida.5 La mayoría de las aprobaciones se basaron en ensayos clínicos no controlados de un solo brazo y requerirán pruebas de eficacia posteriores a la comercialización. JAMA Netw Open, 28 de mayo de 2021

Limitaciones en los ensayos clínicos que conducen a la aprobación de medicamentos contra el cáncer por parte de la FDA
17 junio 2020
Dos tercios de los medicamentos contra el cáncer están aprobados en base a ensayos clínicos con limitaciones en al menos 1 de 4 dominios esenciales. Los esfuerzos para minimizar estas limitaciones en el momento del diseño del ensayo clínico son esenciales para garantizar que los nuevos medicamentos contra el cáncer realmente mejoren los resultados de los pacientes sobre los estándares actuales. JAMA Intern Med. 15 de junio de 2020.
Uso inapropiado de sobrevida libre de progresión en aprobaciones de medicamentos contra el cáncer
13 marzo 2020
