Farmacología

Beneficio añadido e ingresos de los medicamentos oncológicos aprobados por la Agencia Europea de Medicamentos entre 1995 y 2020: estudio de cohorte retrospectivo
29 febrero 2024
Si bien los ingresos parecen alinearse con el beneficio adicional, la mayoría de los medicamentos oncológicos recuperan los costos de I+D en unos pocos años a pesar de proporcionar pocos beneficios adicionales. Esto es particularmente cierto en el caso de los medicamentos aprobados mediante autorizaciones de comercialización condicionales, que inherentemente parecen carecer de pruebas exhaustivas. Los formuladores de políticas deberían evaluar si los incentivos regulatorios y de reembolso actuales promueven efectivamente el desarrollo de los medicamentos más efectivos para los pacientes con mayores necesidades. BMJ 28 de febrero de 2024

Comparación de nuevos medicamentos oncológicos que recibieron doble aprobación de las vías de aprobación acelerada de EE. UU. y autorización de comercialización condicional de la UE, 2006-2021
09 junio 2023
La FDA y la EMA tienen diferentes orientaciones y consideraciones de balance beneficio-riesgo en el uso de aprobación acelerada (AA) o autorización de comercialización condicional (CMA). También se da el caso de que las deficiencias en el diseño e implementación de los estudios posteriores a la comercialización han hecho que sea un desafío obtener la evidencia necesaria para confirmar los beneficios de un medicamento. BMJ Open7 de junio de 2023
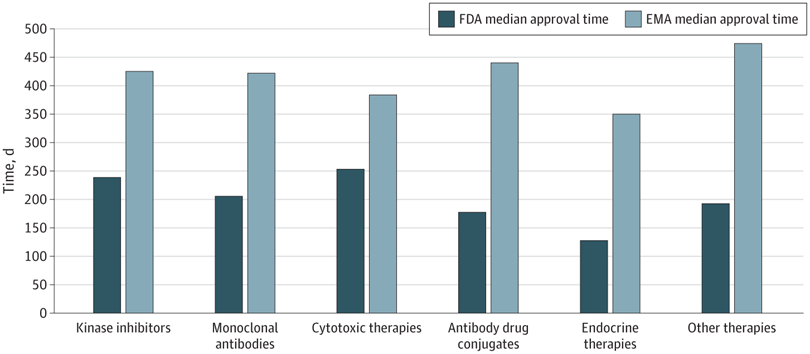
Plazos de aprobación de la terapia del cáncer, velocidad de revisión y publicación de ensayos de registro pivotales en los EE. UU. y Europa, 2010-2019
16 junio 2022
En este estudio transversal, las nuevas terapias oncológicas se aprobaron antes en EE. UU. que en Europa. La FDA recibió las solicitudes de licencia antes y tuvo tiempos de revisión más cortos. Sin embargo, se aprobaron más terapias antes de la publicación del estudio pivotal, lo que genera incertidumbre para los profesionales con respecto a la utilidad clínica y la seguridad de las terapias recientemente aprobadas. JAMA Netw Open. 10 de junio de 2022
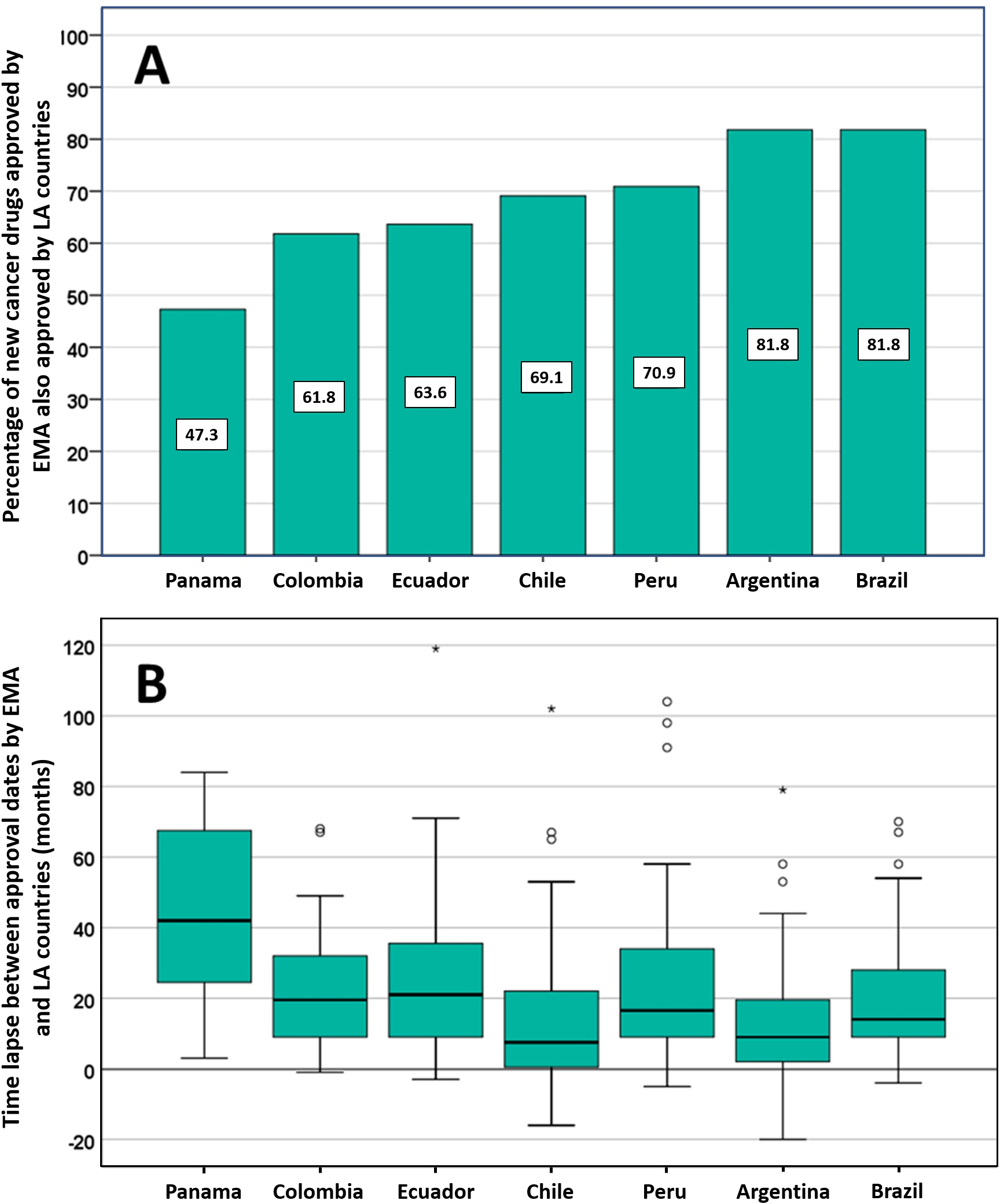
Posible impacto negativo de las decisiones de Agencias reguladoras reputadas sobre el estado de aprobación de nuevos medicamentos contra el cáncer en los países de América Latina
14 julio 2021
Los países de América Latina siguen aprobando nuevos medicamentos contra el cáncer, a menudo basándose en ensayos clínicos mal realizados que miden criterios de valoración sustitutos. La EMA y otros reguladores de renombre deben ser conscientes de que sus decisiones regulatorias pueden influir directamente en las decisiones relativas a la autorización de comercialización, los presupuestos de salud y la atención del paciente en otros lugares. PLoS ONE 13 de julio de 2021

Aprobación de medicamentos oncológicos por vía acelerada: discrepancias entre la FDA y las agencias europeas
23 febrero 2021
