Farmacología
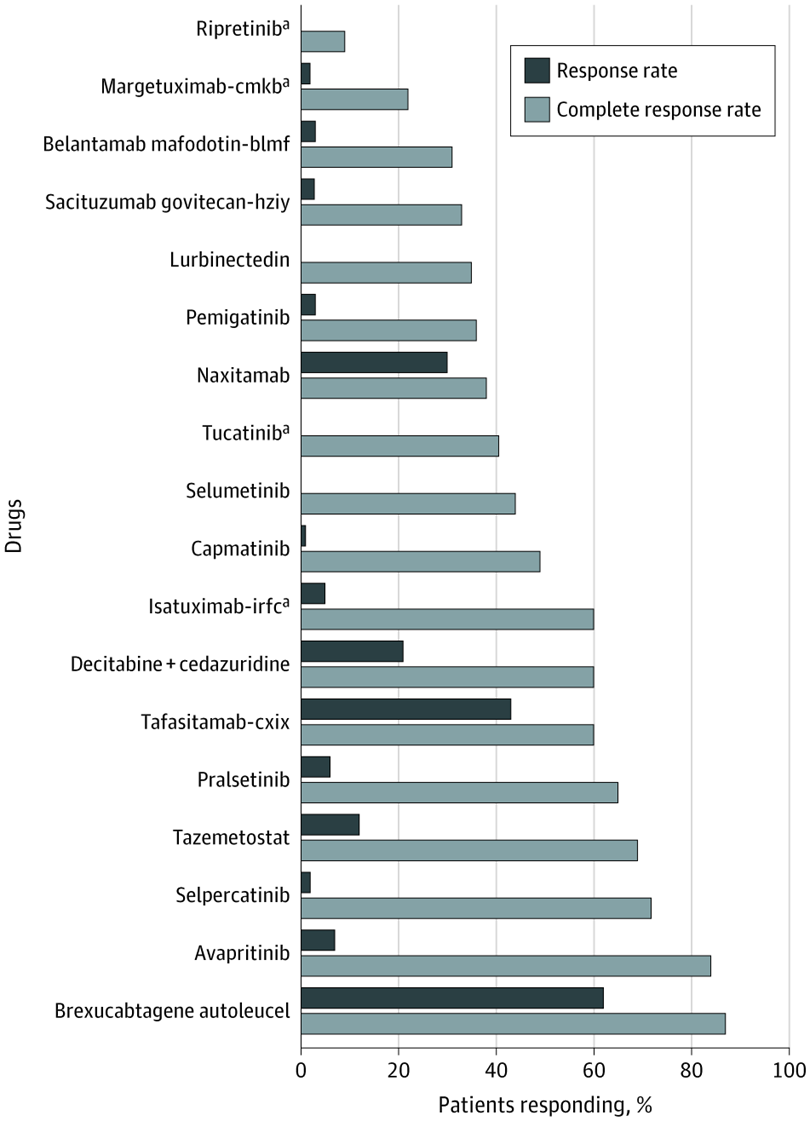
Evaluación de nuevas entidades moleculares aprobadas para el tratamiento del cáncer en 2020
02 junio 2021
La FDA aprobó más nuevas entidades moleculares (NEM) para el cáncer en 2020 que en 2019. Sin embargo, la mayoría de las NEM aprobadas se basaron en criterios de valoración sustitutos con efectos inciertos sobre la supervivencia y la calidad de vida.5 La mayoría de las aprobaciones se basaron en ensayos clínicos no controlados de un solo brazo y requerirán pruebas de eficacia posteriores a la comercialización. JAMA Netw Open, 28 de mayo de 2021
Asociación entre los programas de aprobación acelerada de la FDA y la EMA y el valor terapéutico de los nuevos medicamentos: estudio de cohorte retrospectivo
08 octubre 2020
Menos de un tercio de los nuevos medicamentos aprobados por la FDA y la EMA durante la última década fueron calificados como de alto valor terapéutico por al menos una de las cinco organizaciones independientes. Aunque los medicamentos acelerados tenían más probabilidades de tener una calificación alta que los medicamentos no acelerados, la mayoría de los medicamentos acelerados aprobados por la FDA, pero no por la EMA, fueron calificados como de bajo valor terapéutico. BMJ 7 de octubre de 2020

Limitaciones en los ensayos clínicos que conducen a la aprobación de medicamentos contra el cáncer por parte de la FDA
17 junio 2020
Dos tercios de los medicamentos contra el cáncer están aprobados en base a ensayos clínicos con limitaciones en al menos 1 de 4 dominios esenciales. Los esfuerzos para minimizar estas limitaciones en el momento del diseño del ensayo clínico son esenciales para garantizar que los nuevos medicamentos contra el cáncer realmente mejoren los resultados de los pacientes sobre los estándares actuales. JAMA Intern Med. 15 de junio de 2020.
Agregación y análisis de las relaciones indicación-síntoma para medicamentos aprobados en los EE. UU.
03 junio 2020
Las asociaciones de indicación de fármacos y las asociaciones de síntomas de enfermedad recopiladas en este estudio pueden ser útiles para identificar factores de confusión en otros conjuntos de datos, como los informes de seguridad. Con un mayor refinamiento y medicamentos adicionales, indicaciones y síntomas, este conjunto de datos puede convertirse en un recurso de calidad para los síntomas de la enfermedad. Eur J Clin Pharmacol junio de 2020
Uso inapropiado de sobrevida libre de progresión en aprobaciones de medicamentos contra el cáncer
13 marzo 2020
