Farmacología

Aprobación y regulación de productos farmacéuticos de la FDA, 1983-2018
15 enero 2020
Durante las últimas 4 décadas, los procesos de aprobación y regulación para agentes farmacéuticos han evolucionado y aumentado en complejidad a medida que se han agregado programas especiales y se ha alentado el uso de variables subrogadas. Los fondos de la FDA necesarios para implementar y administrar estos programas se han abordado mediante la expansión de las tarifas de usuario pagadas por la industria. La FDA ha aceptado cada vez menos datos y más medidas subrogadas, y ha acortado sus tiempos de revisión. JAMA, 14 de enero de 2020

Evidencia clínica que respalde la autorización de comercialización de biosimilares en Europa
06 enero 2020
El análisis de la aprobación de biosimilares en Europa muestra un escenario complejo y heterogéneo. El requisito de mostrar similitud en términos de eficacia clínica y seguridad proporciona una demostración sólida de resultados clínicos comparables, pero supone una carga para los fabricantes de biosimilares y puede retrasar la introducción de los medicamentos. El desarrollo, la concesión de licencias y la supervisión de los biosimilares se beneficiarían de nuevas estrategias para acelerar el acceso a estos medicamentos y reducir las incertidumbres sobre su uso en la práctica. Eur J Clin Pharmacol , 2 de enero de 2020
Financiación pública en el desarrollo de nuevos fármacos
29 octubre 2019
Al menos uno de cada cuatro medicamentos nuevos registrados por la FDA entre 2008 y 2017 contaron con financiación pública en la etapa tardía de su desarrollo. Esto debería repercutir en la fijación de un precio justo para estos fármacos. British Medical Journal, 23 de octubre de 2019
Las decisiones de la EMA y la FDA para aprobar nuevos medicamentos contra el cáncer, basadas en evidencias débiles, afectan negativamente a los pacientes latinoamericanos
23 octubre 2019
BMJ, 15 de octubre de 2019
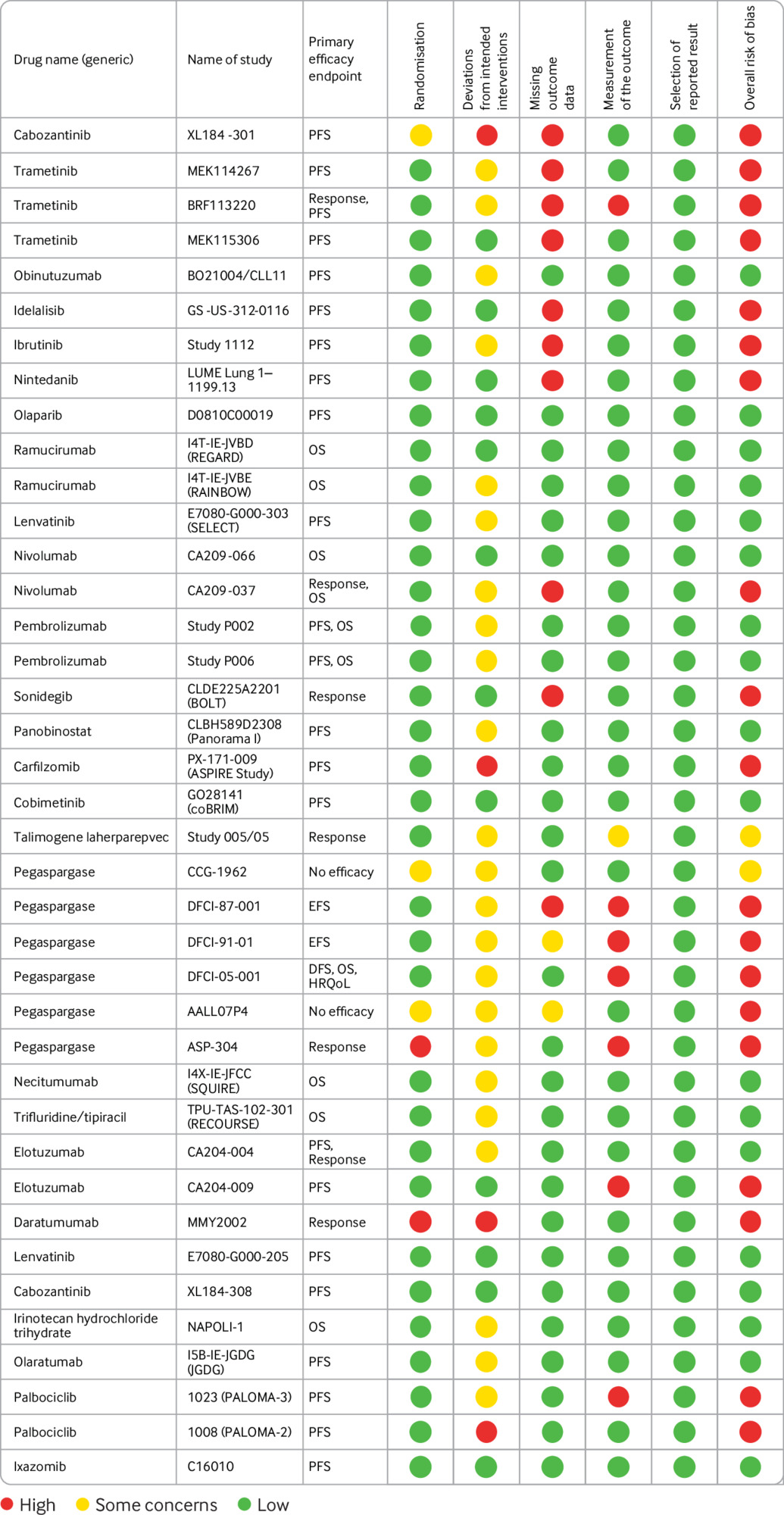
Características de diseño, riesgo de sesgo e informes de ensayos controlados aleatorios que respaldan las aprobaciones de medicamentos contra el cáncer por la Agencia Europea de Medicamentos, 2014-16
19 septiembre 2019
