Farmacología

Precios justos: 3) Estrategias para lograr precios más justos para medicamentos genéricos y biosimilares
15 enero 2020
Alessandra Ferrario y colegas afirman que la entrada temprana al mercado y la rápida incorporación de genéricos y biosimilares con garantía de calidad son clave para mejorar el acceso a los medicamentos. BMJ 13 de enero de 2020

Evidencia clínica que respalde la autorización de comercialización de biosimilares en Europa
06 enero 2020
El análisis de la aprobación de biosimilares en Europa muestra un escenario complejo y heterogéneo. El requisito de mostrar similitud en términos de eficacia clínica y seguridad proporciona una demostración sólida de resultados clínicos comparables, pero supone una carga para los fabricantes de biosimilares y puede retrasar la introducción de los medicamentos. El desarrollo, la concesión de licencias y la supervisión de los biosimilares se beneficiarían de nuevas estrategias para acelerar el acceso a estos medicamentos y reducir las incertidumbres sobre su uso en la práctica. Eur J Clin Pharmacol , 2 de enero de 2020

Biosimilares: una nueva era en el acceso al tratamiento del cáncer de mama
03 enero 2020
Tres patentes principales de producción de trastuzumab que vencen en 2018-2020 han creado una oportunidad para que varios biosimilares trastuzumab sean aprobados por los organismos reguladores, y están listos para ingresar al mercado. Por primera vez, el 18 de diciembre de 2019, la OMS otorgó el estado de "precalificación" a un medicamento biosimilar para el tratamiento del cáncer de mama Lancet, 4 de enero de 2020

Antirreumáticos con diana: biológicos, biosimilares y dirigidos
20 noviembre 2019
Boletín terapéutico andaluz, BTA 34(3) 2019CADIME, 19 de noviembre de 2019Los FAME biológicos y los FAME dirigidos (que no son biológicos) se dirigen a dianas concretas para ejercer su efecto terapéutico. La inhibición de dianas específicas induce respuestas antiinflamatorias, pero también puede inducir respuestas inmunitarias indeseables, por lo que es importante la detección de infecciones, antes y durante el tratamiento con FAME biológicos y FAME dirigidos. También hay que vigilar: tumores malignos y linfoproliferativos, insuficiencia cardiaca, neumopatía y enfermedad desmielinizante.
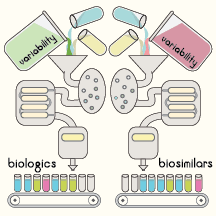
Biosimilares o productos biológicos: ¿Cuál es la diferencia?
13 noviembre 2019
