Farmacología

Limitaciones de los desenlaces sustitutos en la aprobación acelerada de nuevos medicamentos
17 septiembre 2021
Aunque los criterios de valoración sustitutos se utilizan ampliamente para acelerar la aprobación de nuevos fármacos, la mayoría no son predictores fiables de los resultados que más importan a los pacientes. Los reguladores sólo deben aceptar criterios de valoración sustitutos cuando no sea posible generar datos sobre los resultados clínicos. British Medical Journal, 16 de septiembre de 2021.
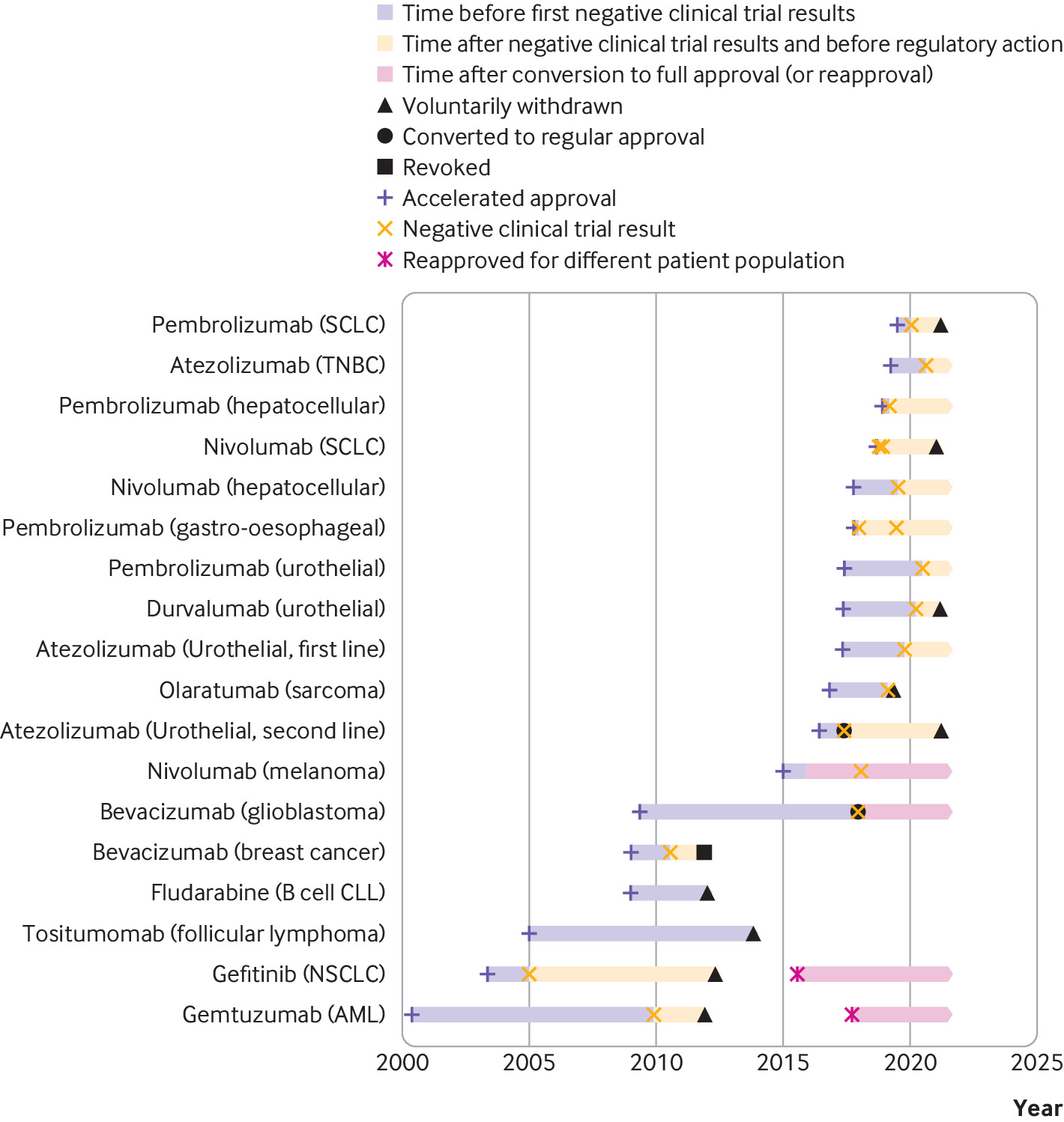
Consecuencias regulatorias y clínicas de los ensayos confirmatorios negativos de medicamentos contra el cáncer de aprobación acelerada
13 septiembre 2021
Las indicaciones de medicamentos contra el cáncer que recibieron una aprobación acelerada a menudo permanecieron en el etiquetado formal de medicamentos aprobados por la FDA y continuaron recomendándose en las guías clínicas varios años después de que los ensayos posteriores a la aprobación requeridos por ley no mostraran una mejoría en el criterio de valoración de eficacia primario. Las guías clínicas deben alinearse mejor con los resultados de los ensayos posteriores a la aprobación de medicamentos contra el cáncer que recibieron una aprobación acelerada. BMJ, 9 de septiembre de 2021
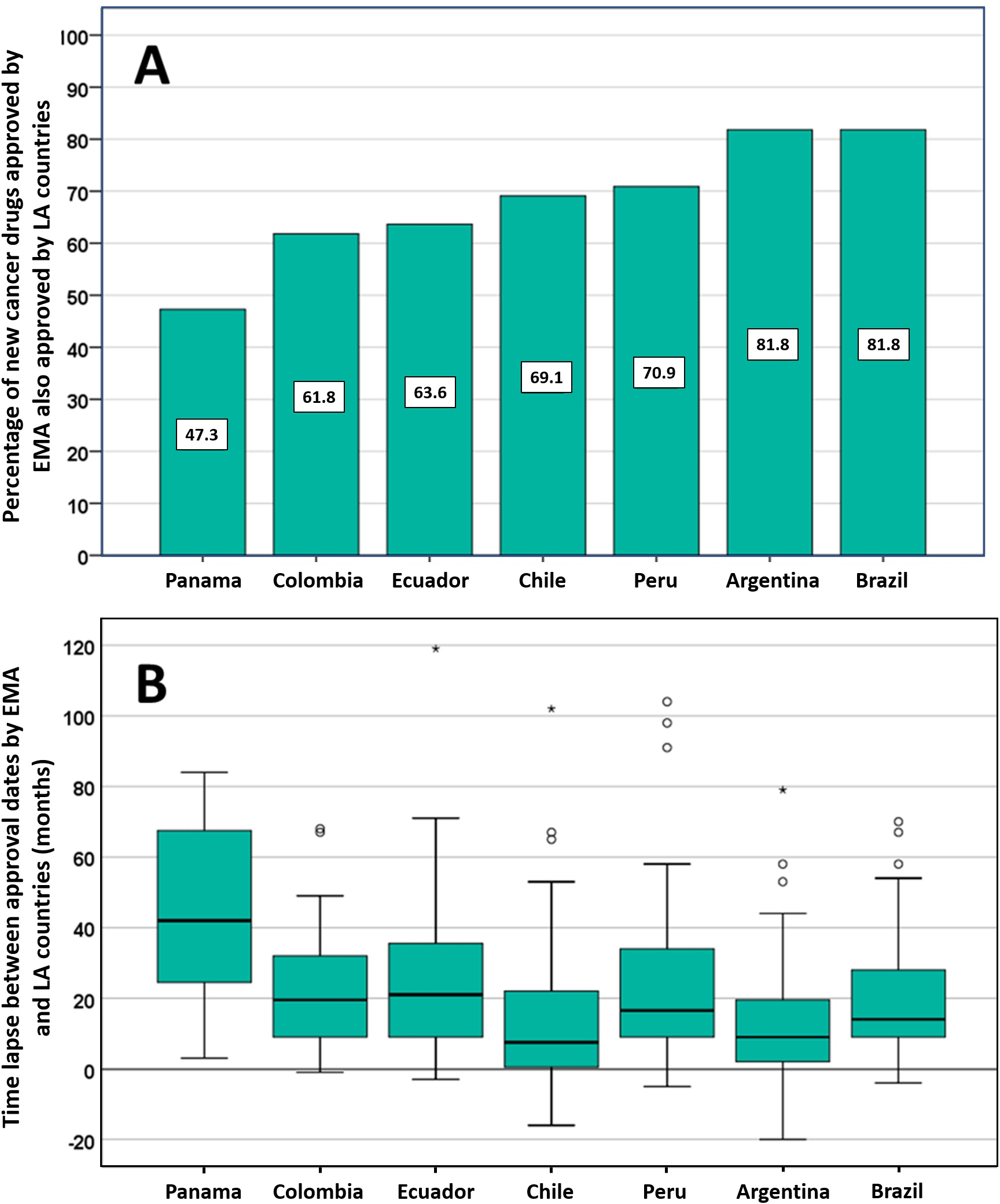
Posible impacto negativo de las decisiones de Agencias reguladoras reputadas sobre el estado de aprobación de nuevos medicamentos contra el cáncer en los países de América Latina
14 julio 2021
Los países de América Latina siguen aprobando nuevos medicamentos contra el cáncer, a menudo basándose en ensayos clínicos mal realizados que miden criterios de valoración sustitutos. La EMA y otros reguladores de renombre deben ser conscientes de que sus decisiones regulatorias pueden influir directamente en las decisiones relativas a la autorización de comercialización, los presupuestos de salud y la atención del paciente en otros lugares. PLoS ONE 13 de julio de 2021

Aprobación de medicamentos oncológicos por vía acelerada: discrepancias entre la FDA y las agencias europeas
23 febrero 2021
Una parte sustancial de los fármacos oncológicos aprobados por la FDA por vía acelerada no fueron evaluados por las autoridades regulatorias europeas, o se les negó o retiró la autorización de comercialización. Además, muchas de las aprobaciones en el Reino Unido quedaban sujetas a acuerdos de reducción de precios. JAMA Internal Medicine, 22 de febrero de 2021.

Evidencia de ensayos clínicos que respalda la aprobación de nuevas terapias contra el cáncer por parte de la Administración de Alimentos y Medicamentos de EE. UU. Entre 2000 y 2016
13 noviembre 2020
