Farmacología
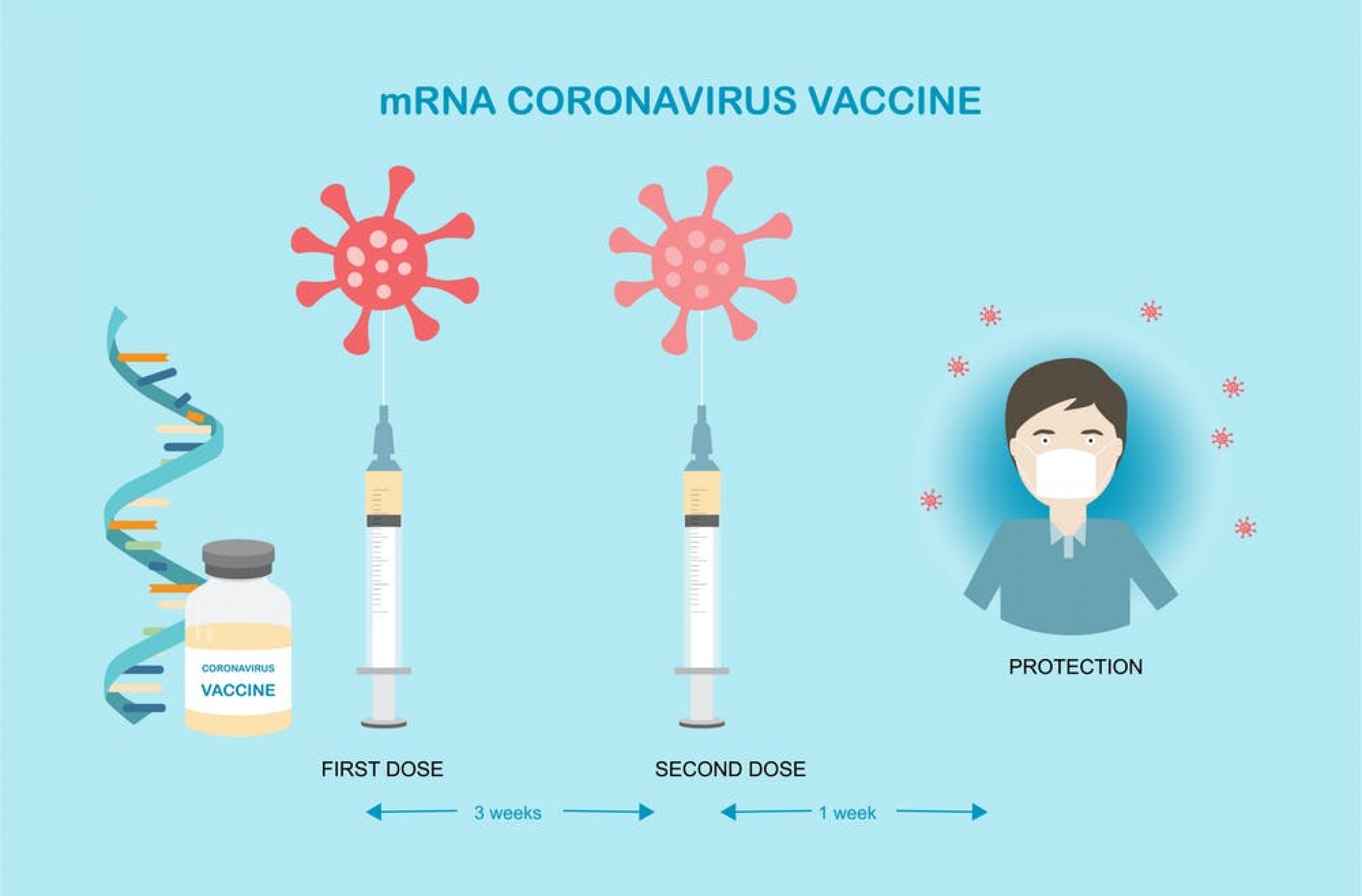
Otra vacuna para el SARS-CoV-2 con resultados favorables en fase 3
04 enero 2021
En un estudio con más de 30.000 participantes, la vacuna mRNA-1273 de Moderna mostró una eficacia del 94,1% para prevenir la enfermedad por Covid-19, incluida las formas graves. Aparte de las reacciones transitorias locales y sistémicas, no se identificaron problemas de seguridad. New England Journal of Medicine, 30 de diciembre de 2020.
COVID-19 es actualmente la principal causa de muerte en los Estados Unidos
30 diciembre 2020
En pleno ascenso de la segunda ola de contagios con coronavirus en EEUU, el COVID ha desplazado a las enfermedades cardíacas y al cáncer como principales causas de muerte. JAMA, 17 de diciembre de 2020.

Contagio del SARS-CoV-2 a partir de casos sintomáticos y asintomáticos
29 diciembre 2020
Un cuidadoso seguimiento de 3700 contactos cercanos de personas con COVID 19 mostró que el riesgo de contagio a partir de un paciente sintomático es casi cuatro veces mayor que el de los casos asintomáticos. The Lancet, 18 de diciembre de 2020.

Plan Operativo de Vacunación contra el SARS-CoV-2
24 diciembre 2020
Se trata del plan diseñado junto a distintas áreas de gobierno y las 24 jurisdicciones para llevar a cabo la vacunación de la población de riesgo, con el objetivo de bajar la mortalidad por COVID-19 en Argentina.Al final se incluyen enlaces al Plan Estratégico para la vacunación contra la COVID-19 en Argentina y a los Lineamientos técnicos de la Campaña de Vacunación contra el COVID-19. Ministerio de Salud de la Nación , 23 de diciembre de 2020

El Ministerio de Salud de la Nación autorizó la vacuna Gam-COVID-Vac (SPUTNIK V)
24 diciembre 2020
