Farmacología
La ANMAT aprobó el suero equino hiperinmune
23 diciembre 2020
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica aprobó el tratamiento para pacientes adultos con enfermedad moderada a severa de COVID-19, mediante el Registro Bajo Condiciones Especiales establecido en la Disposición 4622/2012 (ver al final de la entrada). La aprobación de este medicamento innovador basado en anticuerpos policlonales se fundamentó en los resultados positivos del estudio clínico de Fase 2/3, los cuales mostraron que la aplicación de esta terapia, que demostró ser segura, redujo la mortalidad casi a la mitad (45%) en los pacientes con COVID-19 severa. Además, los pacientes tratados demostraron una reducción de la internación en terapia intensiva de 24% y del requerimiento de asistencia respiratoria mecánica de 36%, frente al placebo. Ministerio de Salud de la Nación, 22 de diciembre de 2020

Informe acerca de las nuevas variantes de SARS-CoV-2 reportadas en Gran Bretaña y Sudáfrica
22 diciembre 2020
Se reporta un linaje de crecimiento rápido en el Reino Unido asociado a un número inusual de cambios genéticos, incluyendo el receptor RDB y asociado al sitio de clivaje de la furina.-Hay evidencia limitada respecto a la severidad de la nueva variante, ya que la mayoría de los casos reportados ocurrieron en individuos menores de 60 años, en los cuales sintomatología esperada es menos severa.-Debido a la evidencia experimental y posibles consecuencias fenotípicas de estos cambios, la falta de evidencia de su efecto combinado y la alta tasa de crecimiento de este linaje en Reino Unido, se requiere la caracterización en detalle del mismo, especialmente en su efecto sobre la neutralización por anticuerpos, por su potencial impacto en individuos vacunados y en aquellos que sufrieron ya infecciones por este virus.-Este linaje no comparte origen común con el reportado en Sudáfrica y ninguno de ellos con los aislamientos secuenciados hasta el momento en nuestro país. Sin embargo, es necesaria una vigilancia genómica continua por la diseminación global de la misma y posible introducción en nuestro país. ANLIS.Carlos G. Malbrán, 21 de diciembre de 2020
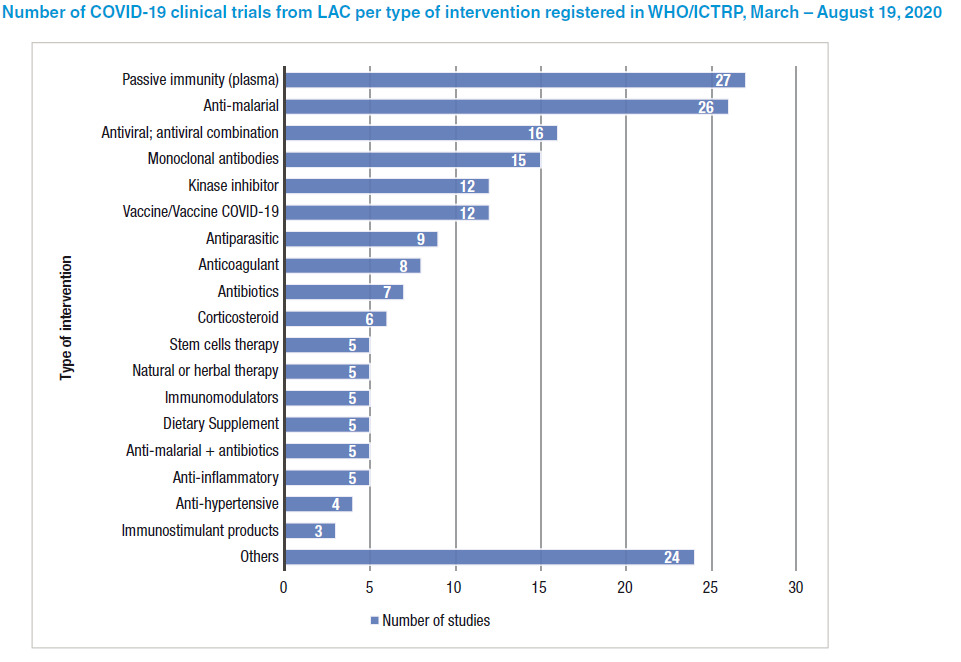
El panorama de los ensayos clínicos sobre COVID-19 en América Latina y el Caribe: evaluación y desafíos
22 diciembre 2020
Se analizaron los ensayos para el tratamiento y la prevención de la COVID-19 de los países de América Latina y el Caribe que están registrados en la Plataforma de Registros Internacionales de Ensayos Clínicos de la Organización Mundial de la Salud, y se identificó una tendencia hacia la realización de estudios pequeños, repetitivos y no rigurosos que duplican los esfuerzos y merman recursos limitados sin producir conclusiones significativas sobre la seguridad y la eficacia de las intervenciones evaluadas Rev Panam Salud Publica, 21 de diciembre de 2020
La EMA recomienda la autorización de la primera vacuna frente a la COVID-19
22 diciembre 2020
Comirnaty es el nombre de la vacuna desarrollada por BioNTech y Pfizer, que previne la enfermedad causada por SARS-CoV-2 en personas a partir de los 16 añosEl CHMP, formado por expertos de las autoridades competentes, entre ellas la AEMPS, ha completado su evaluación científica concluyendo por consenso que el balance beneficio-riesgo es positivo y se dispone de datos suficientemente sólidos sobre la calidad, seguridad y eficacia de esta vacunaAllana así el camino para que la Comisión Europea otorgue la autorización de comercialización condicional al medicamento y se convierta en la primera vacuna autorizada la Unión EuropeaEl ensayo clínico ha contado con la participación de unas 44.000 personas y ha demostrado una eficacia del 95%. AEMPS, 21 de diciembre de 2020

Combinación de baricitinib con remdesivir en pacientes internados por COVID-19
21 diciembre 2020
