Farmacología

Seguridad de los medicamentos en pacientes geriátricos: estado actual y propuesta del camino a seguir
04 junio 2020
Los ancianos están subrepresentados en los ensayos clínicos, especialmente los individuos frágiles cuya respuesta farmacológica y el resultado esperado del tratamiento pueden ser diferentes de los de los pacientes no frágiles. Esto significa que a menudo se desconoce el equilibrio beneficio-riesgo de los medicamentos utilizados en pacientes ancianos frágiles.Presentamos algunas propuestas para superar las barreras que impiden la inscripción de pacientes ancianos frágiles en ensayos clínicos, y estrategias para monitorear su terapia para minimizar el riesgo de reacciones adversas. Drug Saf, 4 de junio de 2020

Los ensayos clínicos de medicamentos contra el coronavirus deben ser más grandes y más colaborativos
15 mayo 2020
Una emergencia pandémica es una razón para que se trabaje más rápido, pero los investigadores no deben perder de vista que las intervenciones experimentales conllevan riesgos inherentes para los pacientes. Para equilibrar este riesgo, los ensayos clínicos deben estar diseñados con la mayor solidez posible. Algunos ensayos pueden ser exploraciones iniciales pequeñas de posibles tratamientos; pero, después de eso, los investigadores deben pensar en grande. Es importante pasar rápidamente a ensayos colaborativos más grandes, que atraviesen fronteras y compartan experiencias y conocimientos, y así tengan una mayor probabilidad de mostrar lo que realmente funciona. Nature, 13 de mayo de 2020

Expectativa por los ensayos clínicos aleatorizados sobre COVID-19
05 mayo 2020
Es sumamente importante presentar e interpretar con claridad los resultados de los ensayos clínicos, y comunicarlos de manera adecuada a los médicos, al público y a los encargados de formular políticas. JAMA, 4 de mayo de 2020.

Cumplimiento de la obligación de informar los resultados de los ensayos clínicos
21 enero 2020
Más de un tercio de los ensayos clínicos registrados en clinicalTrials.gov no cumplen con la obligación legal de informar sus resultados dentro de 1 año de su finalización. The Lancet, 17 de enero de 2020
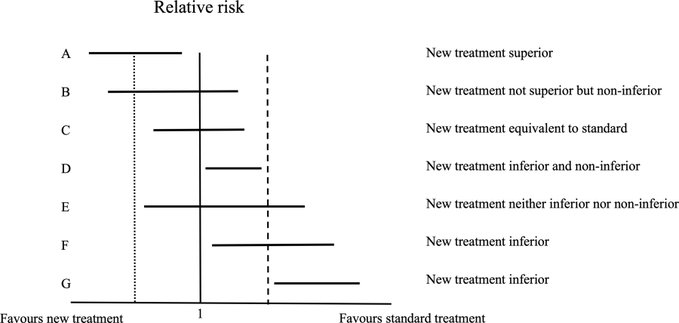
Ensayos de no inferioridad en cardiología: lo que los médicos deben saber
18 diciembre 2019
