Farmacología

Defendiendo la transparencia en la agencia reguladora de medicamentos de Europa
14 enero 2020
BMJ, 8 de enero de 2020 En respuesta a la presión, principalmente de la sociedad civil, la Agencia Europea de Medicamentos introdujo una política para dar acceso público a los documentos en los que basa sus decisiones en la autorización de comercialización de nuevos medicamentos. Editorial de Pierre Chirac

Impacto de los ensayos de resultados cardiovasculares requeridos por la FDA en el inicio del estudio clínico de diabetes tipo 2: 2008-2017
08 enero 2020
A medida que la FDA reconsidera los requisitos posteriores a la comercialización para los productos T2DM, estas observaciones subrayan la importancia de considerar estructuras de estudio posteriores a la comercialización más eficaces para evaluar la seguridad cardiovascular más allá de los ERCV obligatorios. Ther Innov Regul Sci 6 de enero de 2020

Actitudes públicas hacia los usos secundarios de los registros de pacientes para las actividades de las compañías farmacéuticas en Japón
07 enero 2020
Ther Innov Regul Sci , 6 de enero de 2020 los encuestados consideran que el "beneficio público" depende de la distancia relativa de la "promoción de la salud pública" al evaluar el propósito secundario del uso de registros de pacientes. Las compañías farmacéuticas deben incluir los propósitos beneficiosos al usar registros de pacientes con el enfoque de "exclusión voluntaria". Los formuladores de políticas deberían prestar más atención a los propósitos de uso al desarrollar políticas de protección de la información personal.

Evidencia clínica que respalde la autorización de comercialización de biosimilares en Europa
06 enero 2020
El análisis de la aprobación de biosimilares en Europa muestra un escenario complejo y heterogéneo. El requisito de mostrar similitud en términos de eficacia clínica y seguridad proporciona una demostración sólida de resultados clínicos comparables, pero supone una carga para los fabricantes de biosimilares y puede retrasar la introducción de los medicamentos. El desarrollo, la concesión de licencias y la supervisión de los biosimilares se beneficiarían de nuevas estrategias para acelerar el acceso a estos medicamentos y reducir las incertidumbres sobre su uso en la práctica. Eur J Clin Pharmacol , 2 de enero de 2020
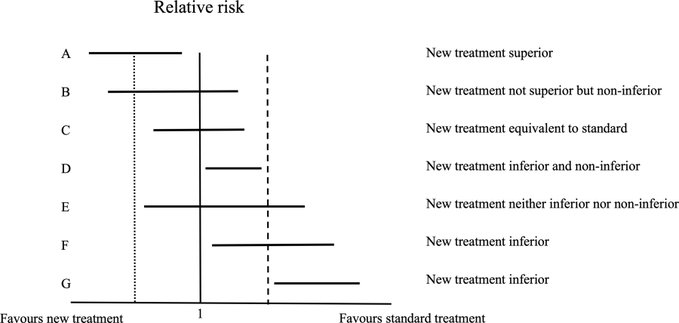
Ensayos de no inferioridad en cardiología: lo que los médicos deben saber
18 diciembre 2019
