Farmacología
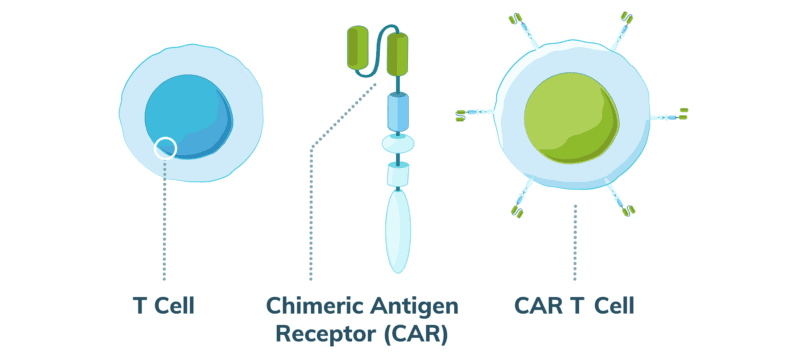
Linfoma de células T derivado de la terapia CAR-T: un nuevo alerta de seguridad
17 enero 2024
Varios pacientes sometidos a terapia con células T modificadas con un receptor de antígeno quimérico (CAR-T) para leucemia linfocítica aguda pediátrica, linfoma no Hodgkin y mieloma múltiple desarrollaron linfoma de células T. El linfoma en cuestión contiene el receptor de antígeno quimérico (CAR) utilizado, lo que significa que el medicamento en sí se ha convertido en una enfermedad maligna. La FDA continúa evaluando las implicancias del hallazgo. JAMA, 11 de enero de 2024.

FDA: Medicamentos antiinflamatorios no esteroides (AINE), evitar uso de AINE durante el embarazo de 20 semanas o más.
16 octubre 2020
Pueden causar disfunción renal fetal, oligohidramnios y, en algunos casos, insuficiencia renal neonatal. FDA , 15 de octubre de 2020

FDA advierte sobre problemas graves con dosis altas del antialérgico difenhidramina (Benadryl). El abuso adolescente provocado por el peligroso "Desafío Benadryl" promovido en las redes sociales
28 septiembre 2020
La Administración de Medicamentos y Alimentos de los EE. UU. (FDA) advierte que tomar dosis más altas que las recomendadas del medicamento común para la alergia de venta libre (OTC) difenhidramina (Benadryl) puede provocar problemas cardíacos graves, convulsiones, coma o incluso la muerte. Se está al tanto de las noticias de adolescentes que terminan en las salas de emergencia o mueren después de participar en el “Desafío Benadryl” alentado en videos publicados en la aplicación de redes sociales TikTok. FDA, 24 de septiembre de 2020

Microbiota fecal para trasplante: alerta de seguridad: protecciones de seguridad adicionales relacionadas con el SARS-CoV-2 y COVID-19
26 marzo 2020
Varios estudios recientes han documentado la presencia de ácido ribonucleico (ARN) SARS-CoV-2 y / o virus SARS-CoV-2 en las heces de individuos infectados. Esta información sugiere que el MFT puede transmitir el SARS-CoV-2, aunque se desconoce el riesgo de dicha transmisión FDA 23 de marzo de 2020

Montelukast (Singulair y genéricos): Advertencia de recuadro reforzado por restricción del uso de la rinitis alérgica
06 marzo 2020
