Farmacología
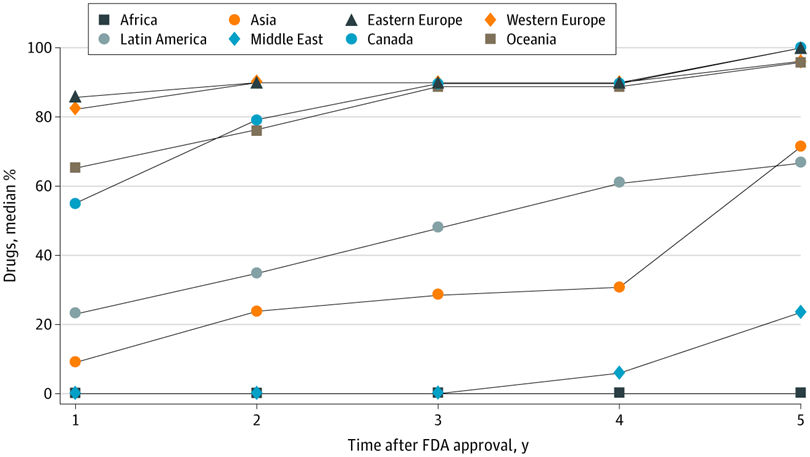
Evaluación de ensayos de medicamentos en países de ingresos altos, medianos y bajos y disponibilidad comercial local de medicamentos recientemente aprobados
17 mayo 2021
Estos hallazgos sugieren que existen brechas sustanciales entre dónde se prueban los medicamentos aprobados por la FDA y dónde finalmente están disponibles para los pacientes, lo que genera inquietudes sobre la distribución equitativa de los beneficios de la investigación a nivel de la población. JAMA Netw Open. 5 de mayo de 2021
La necesidad de distinguir las vacunas COVID-19, y los nombres genéricos
24 febrero 2021
La asignación de una Denominación común internacional (DCI) única y distinta a las sustancias activas de cada vacuna contribuiría a una prescripción segura, una distribución transnacional, una farmacovigilancia mejorada y, en última instancia, la seguridad de los receptores de la vacuna, como ocurre con las sustancias medicinales terapéuticas. Lancet 4 de febrero de 2021

FDA autoriza anticuerpos monoclonales (bamlanivimab y etesevimab ) juntos para el tratamiento del COVID-19
10 febrero 2021
La Administración de Medicamentos y Alimentos de EE. UU. emitió una autorización de uso de emergencia (EUA) para bamlanivimab y etesevimab administrados juntos para el tratamiento de COVID-19 leve a moderado en pacientes adultos y pediátricos (12 años de edad o más que pesen al menos 40 kilogramos ) que dan positivo al SARS-CoV-2 y que tienen un alto riesgo de progresar a COVID-19 grave. FDA , 9 de febrero de 2021

El Ministerio de Salud de la Nación autorizó la vacuna Gam-COVID-Vac (SPUTNIK V)
24 diciembre 2020
Se aprobó mediante la Resolución 2784/2020 del Ministerio de Salud (ver al final), que se basa en la información que recibió la ANMAT sobre la seguridad y eficacia de la vacuna Instituto Gamaleya y a las tareas desarrolladas por la Comisión Nacional de Inmunizaciones que ha prestado su aval correspondiente. Ministerio de Salud de la Nación.23 de diciembre de 2020.

ANMAT: Registro de emergencia de la vacuna de la firma Pfizer S.R.L. "COMIRNATY"
23 diciembre 2020
