Farmacología
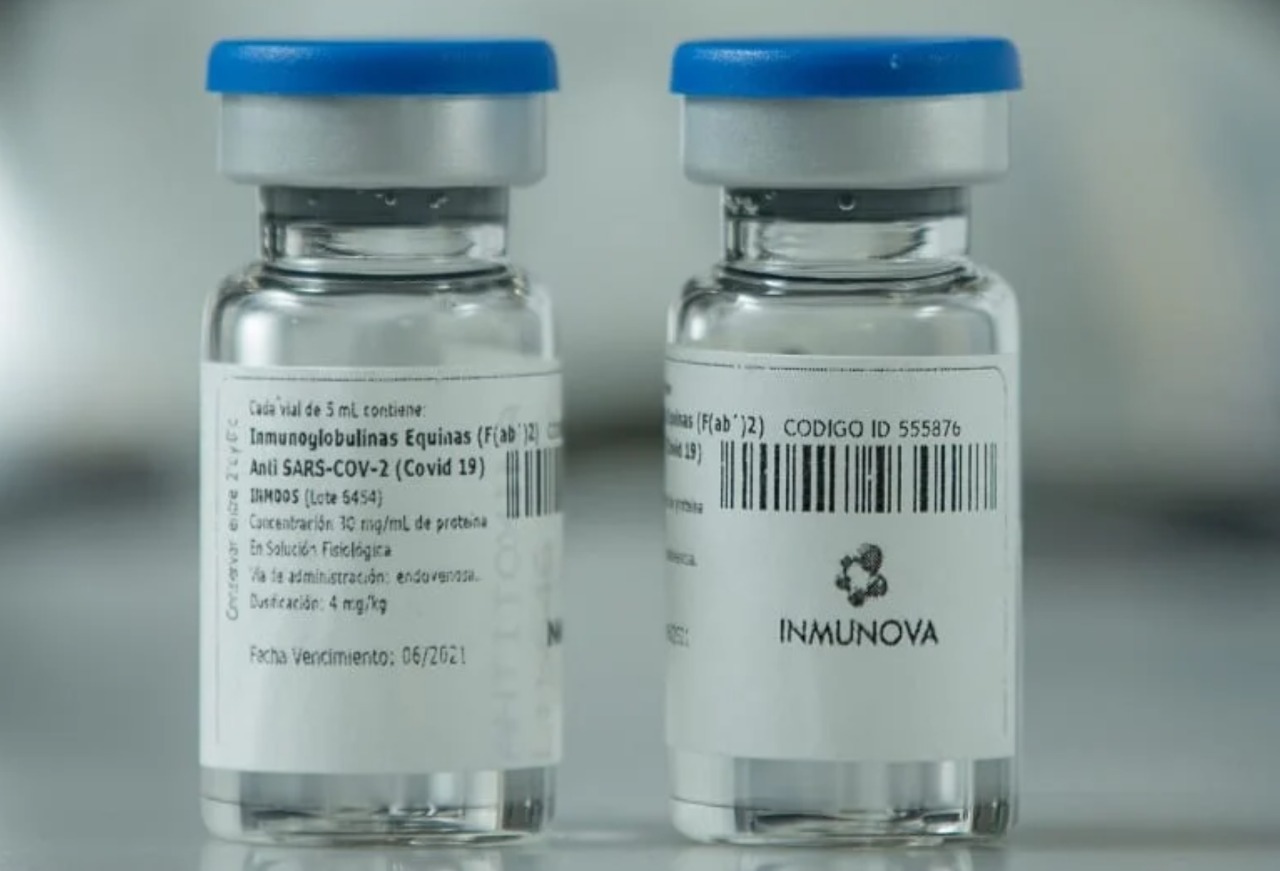
La ANMAT aprobó el suero equino hiperinmune
23 diciembre 2020
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica aprobó el tratamiento para pacientes adultos con enfermedad moderada a severa de COVID-19, mediante el Registro Bajo Condiciones Especiales establecido en la Disposición 4622/2012 (ver al final de la entrada). La aprobación de este medicamento innovador basado en anticuerpos policlonales se fundamentó en los resultados positivos del estudio clínico de Fase 2/3, los cuales mostraron que la aplicación de esta terapia, que demostró ser segura, redujo la mortalidad casi a la mitad (45%) en los pacientes con COVID-19 severa. Además, los pacientes tratados demostraron una reducción de la internación en terapia intensiva de 24% y del requerimiento de asistencia respiratoria mecánica de 36%, frente al placebo. Ministerio de Salud de la Nación, 22 de diciembre de 2020

La revisión integrada: la FDA moderniza la revisión de nuevas aplicaciones de comercialización de medicamentos
03 diciembre 2020
Este artículo describe los orígenes y la justificación del nuevo proceso de Evaluación Integrada y el documento de Revisión Integrada, resume en qué se diferencian de la revisión tradicional de las aplicaciones de marketing de la FDA y analiza lo que la industria puede esperar de una revisión de medicamentos modernizada. Ther Innov Regul Sci 24 de noviembre de 2020

ANMAT: Vacunas para SARS-CoV-2 con documentación en proceso de presentación para su registro
03 diciembre 2020
ANMAT pone a disposición la lista de titulares que han comenzado a presentar documentación para el registro de la vacuna para SARS-CoV-2. ANMAT 2 de diciembre de 2020

Evidencia de ensayos clínicos que respalda la aprobación de nuevas terapias contra el cáncer por parte de la Administración de Alimentos y Medicamentos de EE. UU. Entre 2000 y 2016
13 noviembre 2020
En este estudio de eficacia comparativa de 92 nuevas terapias contra el cáncer aprobadas para 100 indicaciones durante 17 años, el 44% de las aprobaciones de medicamentos se basaron en datos de ensayos clínicos no aleatorizados. Los ensayos clínicos aleatorizados generalmente informaron que estos medicamentos se asociaron con respuestas tumorales sustanciales y retrasos en el tiempo hasta la progresión o la muerte, pero el aumento absoluto medio en la supervivencia general fue de solo 2 meses. JAMA Netw Open. 2 de noviembre de 2020

Polémica por la aprobación del remdesivir por la FDA
02 noviembre 2020
