Farmacología
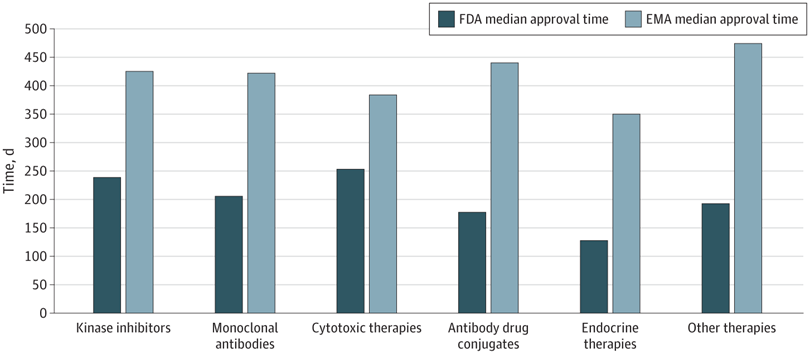
Plazos de aprobación de la terapia del cáncer, velocidad de revisión y publicación de ensayos de registro pivotales en los EE. UU. y Europa, 2010-2019
16 junio 2022
En este estudio transversal, las nuevas terapias oncológicas se aprobaron antes en EE. UU. que en Europa. La FDA recibió las solicitudes de licencia antes y tuvo tiempos de revisión más cortos. Sin embargo, se aprobaron más terapias antes de la publicación del estudio pivotal, lo que genera incertidumbre para los profesionales con respecto a la utilidad clínica y la seguridad de las terapias recientemente aprobadas. JAMA Netw Open. 10 de junio de 2022

Aprobación de medicamentos por la FDA y la ética de la desesperación
29 octubre 2021
Cuando los pacientes tienen un diagnóstico de desesperación que los deja frente a una enfermedad que limita la vida sin buenas opciones de tratamiento, ¿qué papel debe desempeñar su voluntad de probar un medicamento de beneficio no probado en la toma de decisiones regulatorias? En este punto de vista, argumentamos que las voces de los pacientes deben integrarse en el proceso de aprobación de medicamentos, pero sin tal deferencia que la FDA abdique de su responsabilidad de garantizar que los medicamentos sean seguros y efectivos. JAMA Intern Med, 25 de octubre de 2021

Impacto de la Unión Europea en el acceso a medicamentos en países de ingresos bajos y medianos: revisión exploratoria
12 octubre 2021
Esta revisión revela que los tomadores de decisión de la UE adoptan medidas que, a pesar de la escasa evidencia que sustenta su impacto, positivo o negativo, tienen el potencial de influir en el acceso a los medicamentos de los países de bajo y mediano ingreso (PBMI). The Lancet Regional Health – Europe, 1 de octubre de 2021
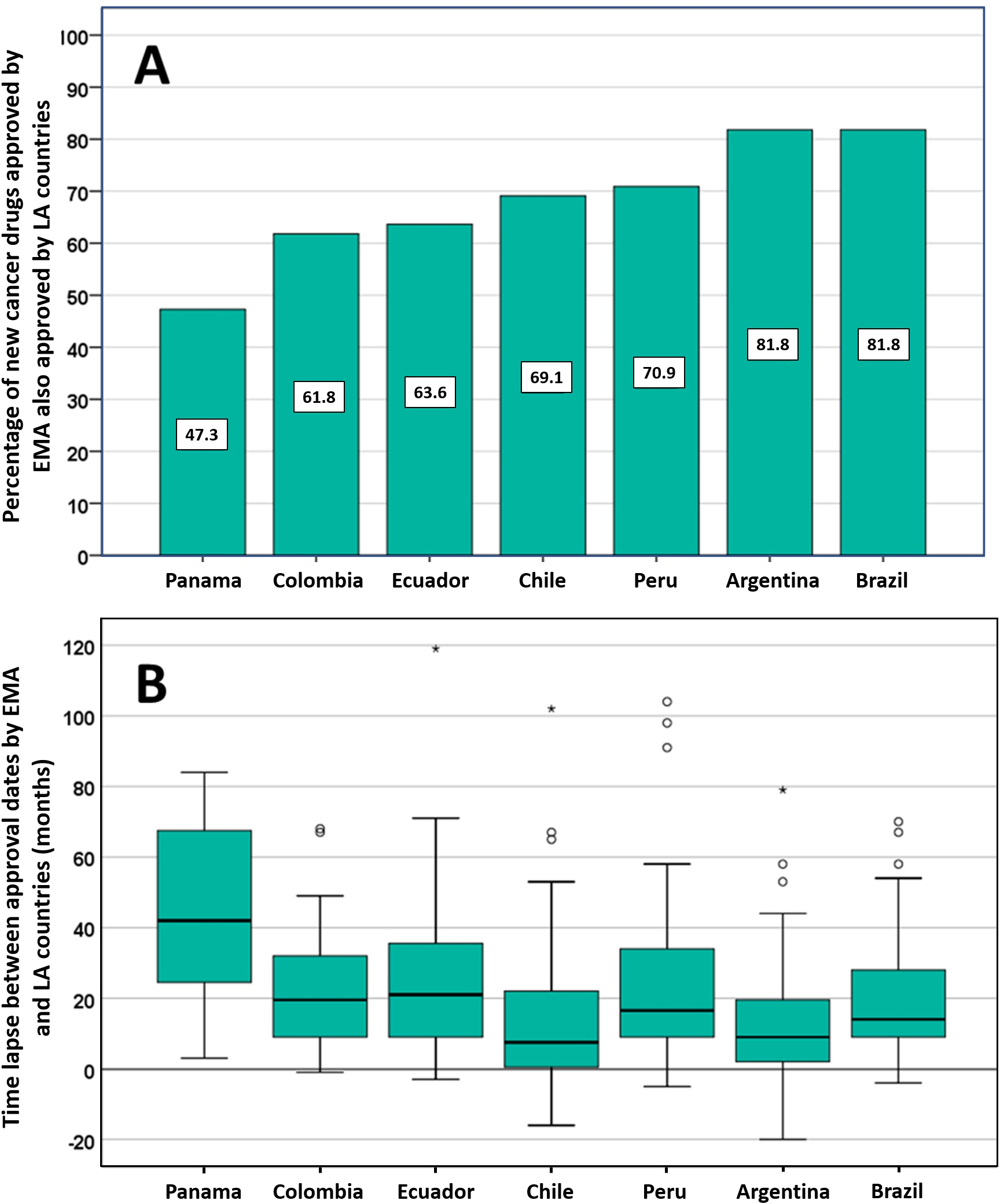
Posible impacto negativo de las decisiones de Agencias reguladoras reputadas sobre el estado de aprobación de nuevos medicamentos contra el cáncer en los países de América Latina
14 julio 2021
Los países de América Latina siguen aprobando nuevos medicamentos contra el cáncer, a menudo basándose en ensayos clínicos mal realizados que miden criterios de valoración sustitutos. La EMA y otros reguladores de renombre deben ser conscientes de que sus decisiones regulatorias pueden influir directamente en las decisiones relativas a la autorización de comercialización, los presupuestos de salud y la atención del paciente en otros lugares. PLoS ONE 13 de julio de 2021
Análisis del precio de lanzamiento y posterior a la aprobación de los medicamentos contra el cáncer, los beneficios clínicos y las implicaciones de las políticas en los EE. UU. y Europa
12 julio 2021
