Farmacología
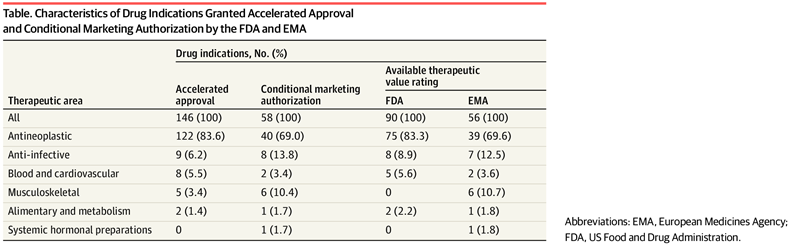
Valor terapéutico de los medicamentos con aprobación acelerada o autorización de comercialización condicional en los EE. UU. y Europa de 2007 a 2021
23 agosto 2022
En este estudio de cohortes, entre las nuevas indicaciones de medicamentos aprobadas a través de las vías de aprobación acelerada o autorización de comercialización condicional en los EE. UU. y Europa de 2007 a 2021, el 38,9 % y el 37,5 %, respectivamente, demostraron un alto valor terapéutico. Una proporción sustancialmente menor de indicaciones de cáncer que de indicaciones no oncológicas fueron calificadas como de alto valor terapéutico. Los encargados de formular políticas y los reguladores deben aumentar la aplicación de la finalización oportuna del estudio posterior a la aprobación para los medicamentos que califican para estas vías. JAMA Health Forum. 19 de agosto de 2022
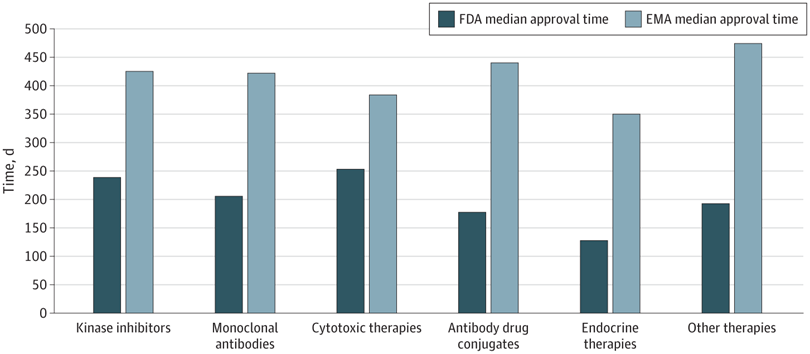
Plazos de aprobación de la terapia del cáncer, velocidad de revisión y publicación de ensayos de registro pivotales en los EE. UU. y Europa, 2010-2019
16 junio 2022
En este estudio transversal, las nuevas terapias oncológicas se aprobaron antes en EE. UU. que en Europa. La FDA recibió las solicitudes de licencia antes y tuvo tiempos de revisión más cortos. Sin embargo, se aprobaron más terapias antes de la publicación del estudio pivotal, lo que genera incertidumbre para los profesionales con respecto a la utilidad clínica y la seguridad de las terapias recientemente aprobadas. JAMA Netw Open. 10 de junio de 2022
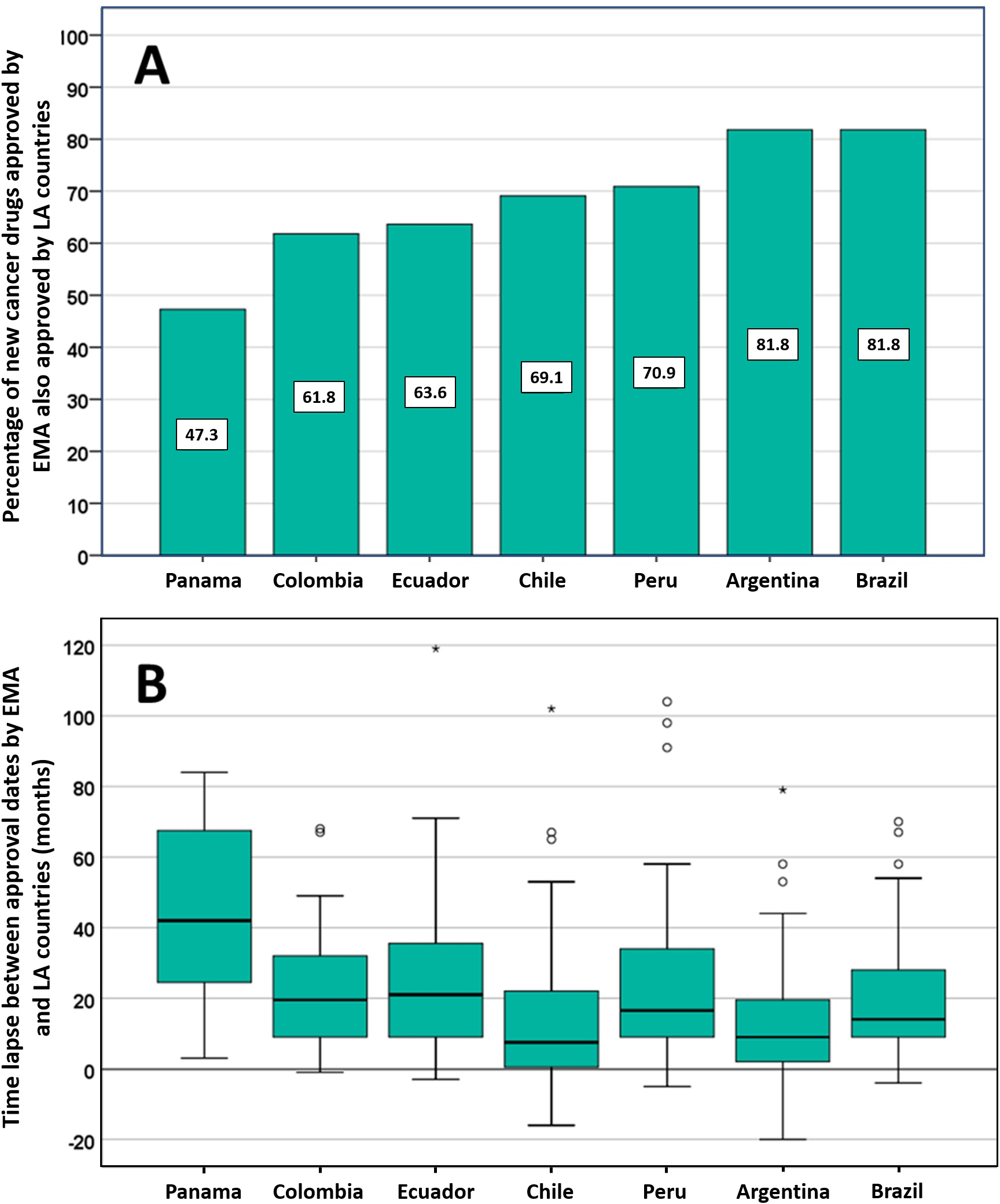
Posible impacto negativo de las decisiones de Agencias reguladoras reputadas sobre el estado de aprobación de nuevos medicamentos contra el cáncer en los países de América Latina
14 julio 2021
Los países de América Latina siguen aprobando nuevos medicamentos contra el cáncer, a menudo basándose en ensayos clínicos mal realizados que miden criterios de valoración sustitutos. La EMA y otros reguladores de renombre deben ser conscientes de que sus decisiones regulatorias pueden influir directamente en las decisiones relativas a la autorización de comercialización, los presupuestos de salud y la atención del paciente en otros lugares. PLoS ONE 13 de julio de 2021
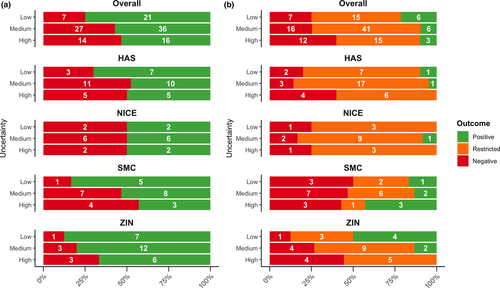
Asociación entre las incertidumbres identificadas por la Agencia Europea de Medicamentos y la toma de decisiones nacional sobre el reembolso por parte de las agencias de ETS
18 mayo 2021
En conclusión, la alta incertidumbre identificada por la EMA se asoció con evaluaciones de efectividad relativa (EER) negativas y recomendaciones de reembolso generales negativas. Para reducir la incertidumbre y, en última instancia, facilitar el acceso eficiente de los pacientes, los reguladores, las agencias de ETS y otras partes interesadas deben analizar cómo se deben sopesar y abordar las incertidumbres en las primeras etapas del ciclo de vida del fármaco de los tratamientos innovadores. Clin Transl Sci 30 de marzo de 2021

Aprobación de medicamentos oncológicos por vía acelerada: discrepancias entre la FDA y las agencias europeas
23 febrero 2021
