Farmacología
Asociación entre los programas de aprobación acelerada de la FDA y la EMA y el valor terapéutico de los nuevos medicamentos: estudio de cohorte retrospectivo
08 octubre 2020
Menos de un tercio de los nuevos medicamentos aprobados por la FDA y la EMA durante la última década fueron calificados como de alto valor terapéutico por al menos una de las cinco organizaciones independientes. Aunque los medicamentos acelerados tenían más probabilidades de tener una calificación alta que los medicamentos no acelerados, la mayoría de los medicamentos acelerados aprobados por la FDA, pero no por la EMA, fueron calificados como de bajo valor terapéutico. BMJ 7 de octubre de 2020
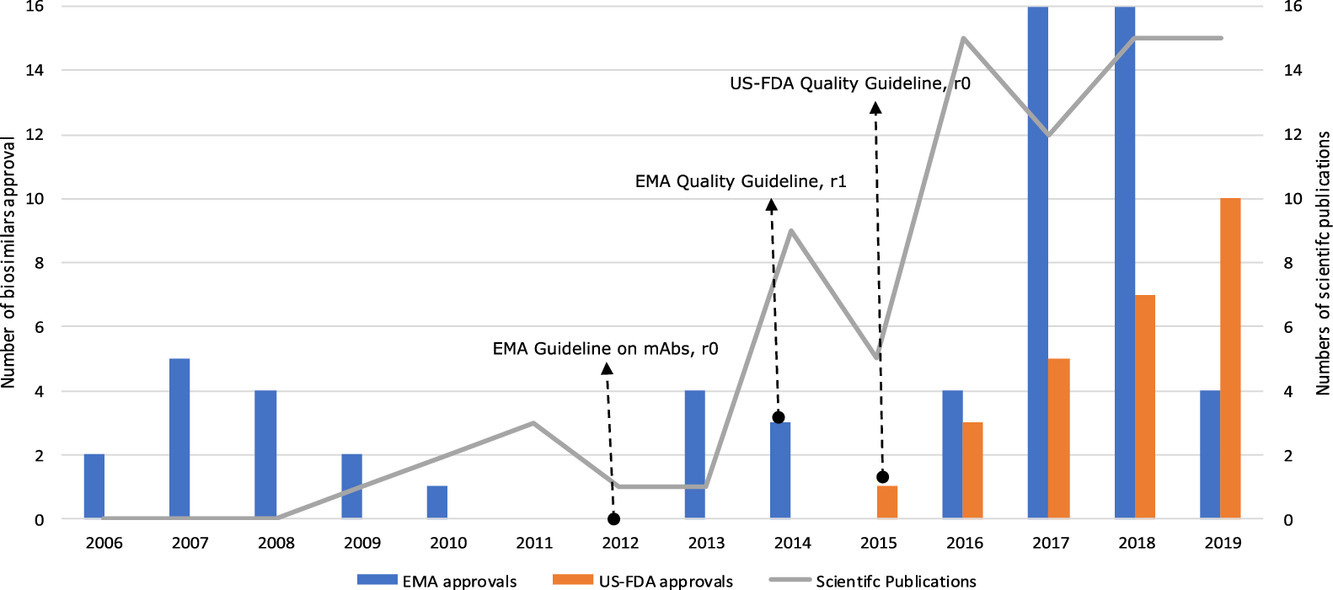
Informe de atributos de calidad en publicaciones científicas que presentan evaluaciones de biosimilaridad de biosimilares (previstos): una revisión sistemática de la literatura
31 julio 2020
Las evaluaciones de biosimilaridad de los atributos de calidad (QA) se han publicado en publicaciones científicas revisadas por pares para aproximadamente el 60% de los biosimilares aprobados. La dinámica de las publicaciones y los tipos de QA de informes aumentaron con el tiempo en paralelo con un mayor número de biosimilares con licencia y parece verse afectada por el desarrollo de pautas regulatorias en 2012-2015.La disponibilidad de una evaluación completa, públicamente accesible (acceso abierto) e imparcial de biosimilaridad de QA podría contribuir a una mayor confianza y aceptación de biosimilares en la práctica clínica. Eur J Pharm Sci, 30 de julio de 2020

Defendiendo la transparencia en la agencia reguladora de medicamentos de Europa
14 enero 2020
BMJ, 8 de enero de 2020 En respuesta a la presión, principalmente de la sociedad civil, la Agencia Europea de Medicamentos introdujo una política para dar acceso público a los documentos en los que basa sus decisiones en la autorización de comercialización de nuevos medicamentos. Editorial de Pierre Chirac
Las decisiones de la EMA y la FDA para aprobar nuevos medicamentos contra el cáncer, basadas en evidencias débiles, afectan negativamente a los pacientes latinoamericanos
23 octubre 2019
BMJ, 15 de octubre de 2019

Concordancia entre EMA y FDA en las autorizaciones de nuevos medicamentos
21 agosto 2019
