Farmacología
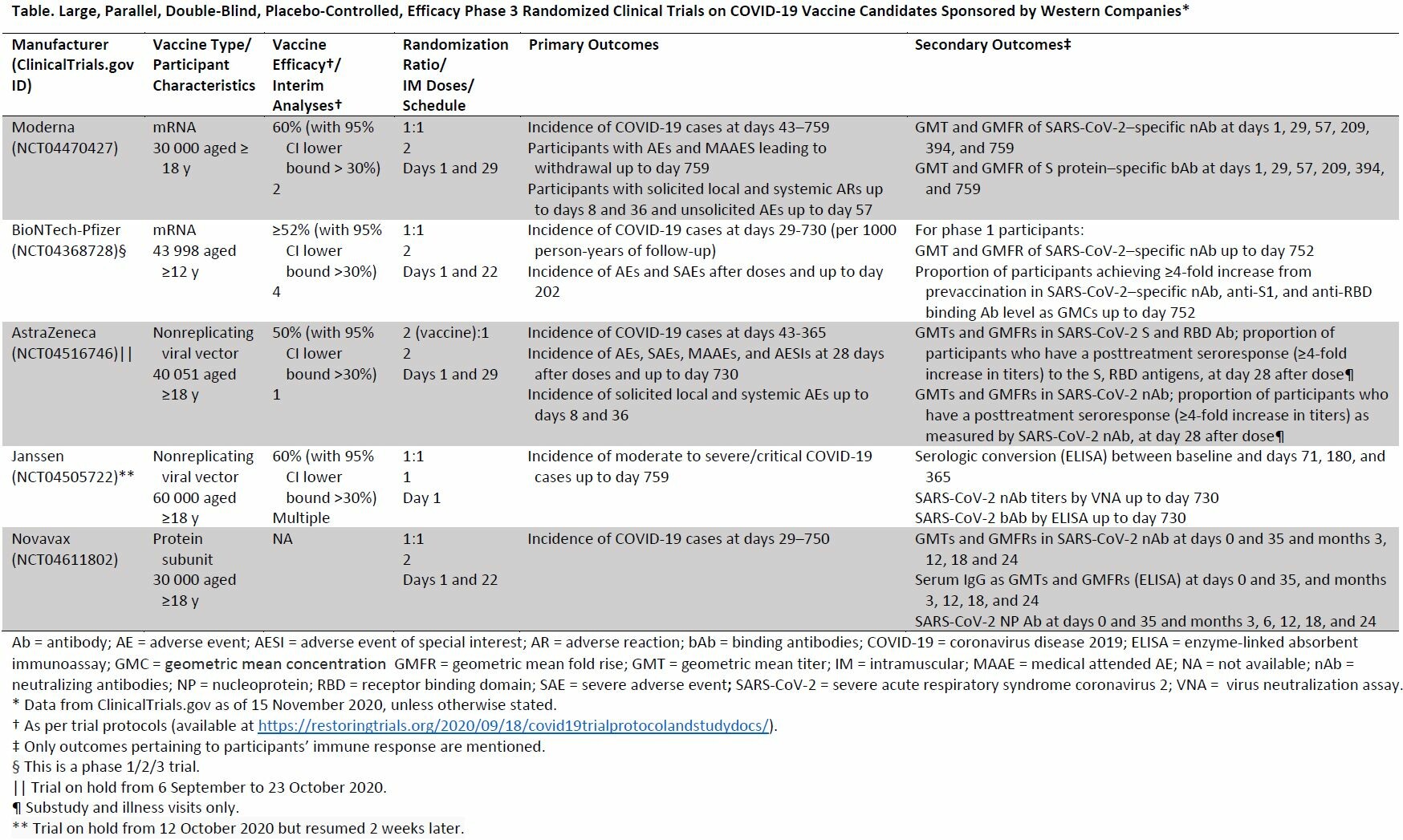
Consideraciones éticas y científicas respecto a la aprobación temprana y de implementación de una vacuna COVID-19
24 noviembre 2020
Este escenario no responderá preguntas sobre la eficacia y seguridad a largo plazo, que requieren datos de un mayor número de meses. Además, la implementación temprana podría interferir con la obtención de datos a largo plazo. En los países donde se implementa la vacuna aprobada y el ensayo original continúa, los investigadores deben informar a los participantes del estudio sobre el estado de la vacuna aprobada porque esta información podría afectar su voluntad de continuar participando en el ensayo Ann Intern Med, 20 de noviembre de 2020
Recuperación en el domicilio luego del alta hospitalaria por COVID-19
24 noviembre 2020
Al cabo de un mes de seguimiento, la mayoría de los pacientes estaba de alta; hubo un 10% de reingresos y 1% de mortalidad, especialmente en pacientes con enfermedades crónicas previas. Annals of Internal Medicine, 24 de noviembre de 2020.

OMS. Terapéutica y COVID-19: guía viva (continua). Recomienda no usar remdesivir
20 noviembre 2020
La OMS ha emitido una recomendación condicional contra el uso de remdesivir en pacientes hospitalizados, independientemente de la gravedad de la enfermedad, ya que actualmente no hay evidencia de que remdesivir mejore la supervivencia y otros resultados en estos pacientes.Esta recomendación, publicada el 20 de noviembre, es parte de una guía viva sobre la atención clínica para COVID-19. Fue desarrollado por un grupo internacional de desarrollo de guías, que incluye a 28 expertos en atención clínica, 4 socios-pacientes y un especialista en ética. OMS 20 de noviembre de 2020

Ensayos comparativos: una cuestión de ética
20 noviembre 2020
La acumulación de evidencia de que la hidroxicloroquina (Plaquenil °) no tiene la eficacia esperada en la enfermedad de covid-19 ha demostrado los riesgos médicos y éticos del uso de medicamentos basados en evidencia insuficiente.La pandemia del covid-19 ha sido motivo de una fuerte exposición mediática de la investigación médica, sus métodos, sus incertidumbres, sus controversias y sus manipulaciones. Entre las cuestiones debatidas apasionadamente está la de los ensayos comparativos, desde perspectivas científicas y éticas. Prescrire 1 de noviembre de 2020

Seguridad e inmunogenicidad de la vacuna ChAdOx1 nCoV-19 administrada en un régimen de refuerzo primario en adultos jóvenes y ancianos (COV002): un ensayo simple ciego, aleatorizado, controlado, de fase 2/3
19 noviembre 2020
