Farmacología

Eficacia y precio de los medicamentos oncológicos aprobados por la FDA
01 noviembre 2022
No se detectó una asociación significativa entre los precios de los medicamentos contra el cáncer y la magnitud del beneficio para ninguno de los desenlaces utilizados. Esto sugiere que los precios de los medicamentos oncológicos se basan predominantemente en lo que puede soportar el mercado. Corregir esta tendencia es vital para la solvencia del desarrollo sanitario y farmacéutico. JAMA Internal Medicine, 31 de octubre de 2022.

Validez de los desenlaces subrogados: qué dicen las evaluaciones de la FDA
27 octubre 2022
La gran mayoría de los análisis de la FDA no encontraron correlaciones sólidas entre los desenlaces sustitutos y la supervivencia general, lo que genera preocupación sobre el uso de tales resultados como criterios de valoración en los ensayos clínicos. Como la mayoría de los estudios se basaron en datos limitados, se requiere más investigación para evaluar la verdadera validez de estos resultados indirectos. Journal of Cancer Policy, diciembre de 2022.

Limitaciones de los desenlaces sustitutos en la aprobación acelerada de nuevos medicamentos
17 septiembre 2021
Aunque los criterios de valoración sustitutos se utilizan ampliamente para acelerar la aprobación de nuevos fármacos, la mayoría no son predictores fiables de los resultados que más importan a los pacientes. Los reguladores sólo deben aceptar criterios de valoración sustitutos cuando no sea posible generar datos sobre los resultados clínicos. British Medical Journal, 16 de septiembre de 2021.

¿Deberían las autoridades reguladoras aprobar medicamentos basados en desenlaces subrogados?
17 septiembre 2021
La controversia del aducanumab es el último ejemplo de criterios de valoración sustitutos que no predicen resultados clínicamente importantes. Sin embargo, como informan Jeanne Lenzer y Shannon Brownlee, se utilizan cada vez más como la base para las aprobaciones de medicamentos. BMJ 16 de septiembre de 2021
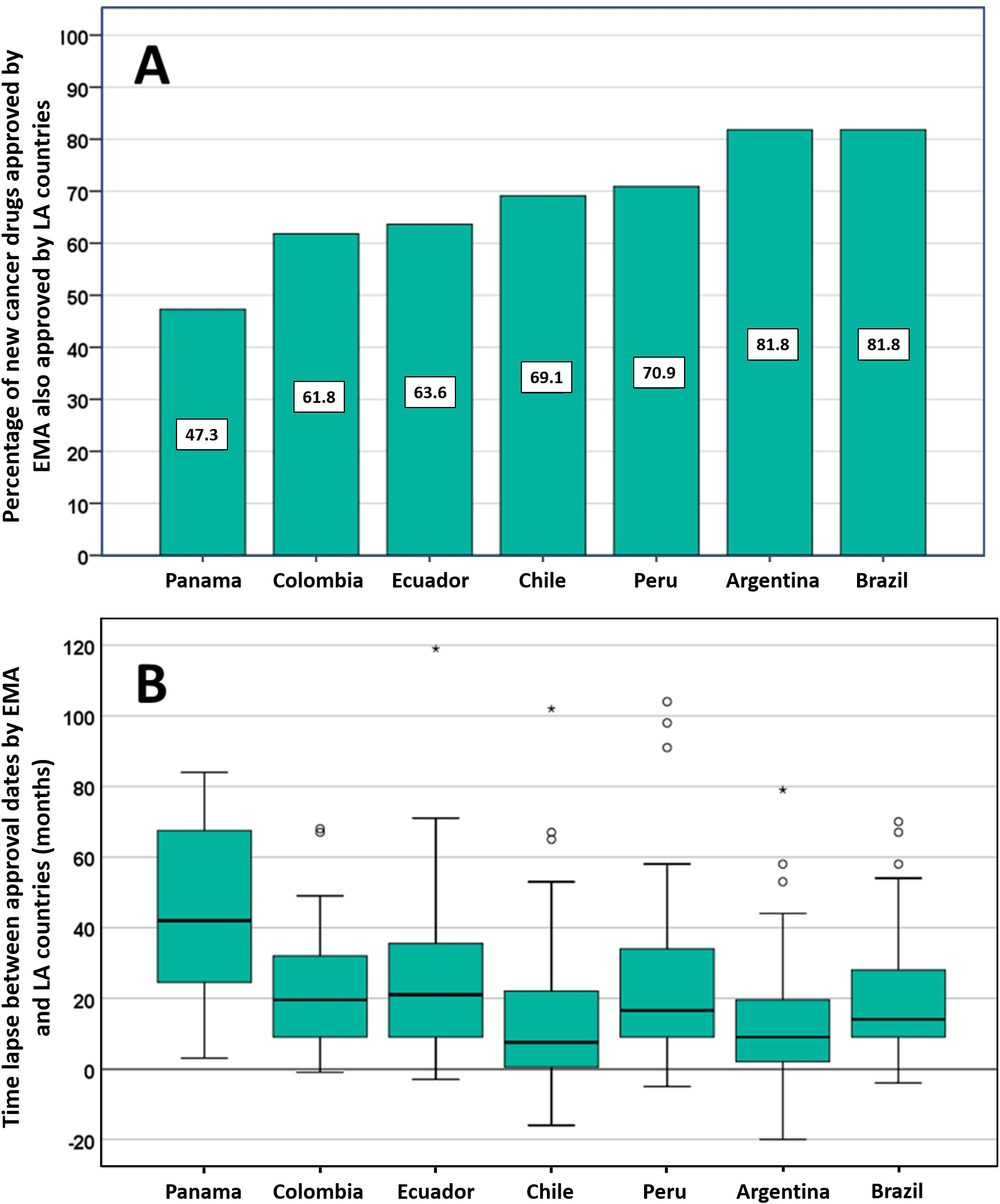
Posible impacto negativo de las decisiones de Agencias reguladoras reputadas sobre el estado de aprobación de nuevos medicamentos contra el cáncer en los países de América Latina
14 julio 2021
