Farmacología
La EMA recomienda la autorización de la primera vacuna frente a la COVID-19
22 diciembre 2020
Comirnaty es el nombre de la vacuna desarrollada por BioNTech y Pfizer, que previne la enfermedad causada por SARS-CoV-2 en personas a partir de los 16 añosEl CHMP, formado por expertos de las autoridades competentes, entre ellas la AEMPS, ha completado su evaluación científica concluyendo por consenso que el balance beneficio-riesgo es positivo y se dispone de datos suficientemente sólidos sobre la calidad, seguridad y eficacia de esta vacunaAllana así el camino para que la Comisión Europea otorgue la autorización de comercialización condicional al medicamento y se convierta en la primera vacuna autorizada la Unión EuropeaEl ensayo clínico ha contado con la participación de unas 44.000 personas y ha demostrado una eficacia del 95%. AEMPS, 21 de diciembre de 2020
Asociación entre los programas de aprobación acelerada de la FDA y la EMA y el valor terapéutico de los nuevos medicamentos: estudio de cohorte retrospectivo
08 octubre 2020
Menos de un tercio de los nuevos medicamentos aprobados por la FDA y la EMA durante la última década fueron calificados como de alto valor terapéutico por al menos una de las cinco organizaciones independientes. Aunque los medicamentos acelerados tenían más probabilidades de tener una calificación alta que los medicamentos no acelerados, la mayoría de los medicamentos acelerados aprobados por la FDA, pero no por la EMA, fueron calificados como de bajo valor terapéutico. BMJ 7 de octubre de 2020
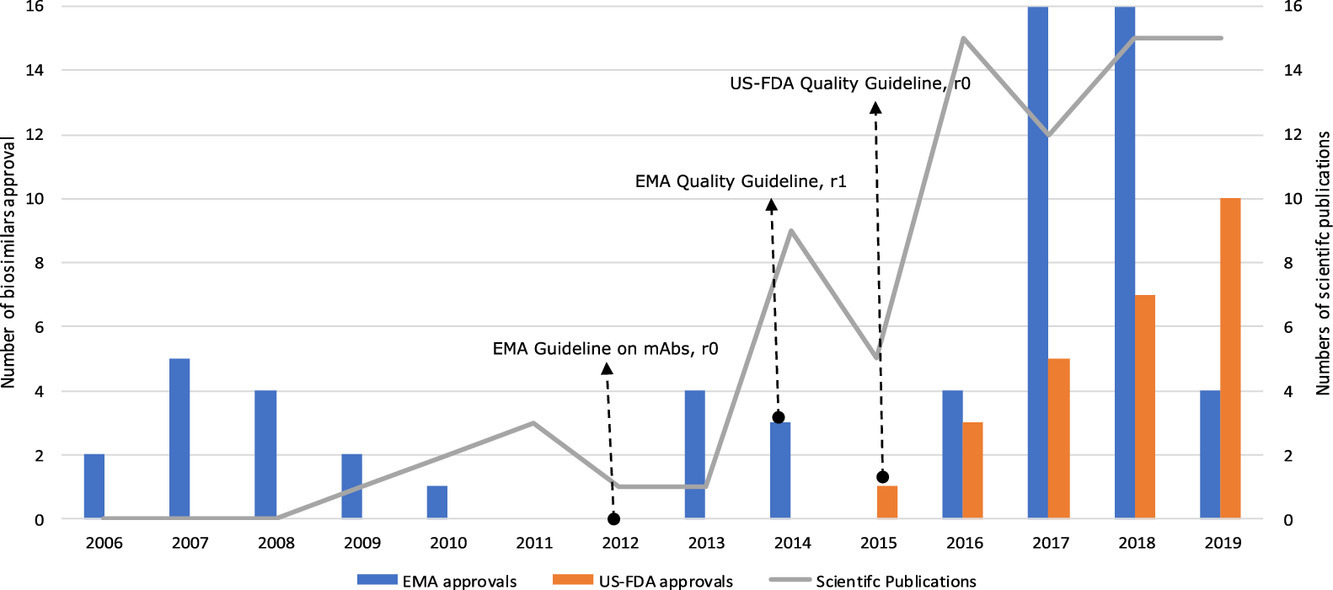
Informe de atributos de calidad en publicaciones científicas que presentan evaluaciones de biosimilaridad de biosimilares (previstos): una revisión sistemática de la literatura
31 julio 2020
Las evaluaciones de biosimilaridad de los atributos de calidad (QA) se han publicado en publicaciones científicas revisadas por pares para aproximadamente el 60% de los biosimilares aprobados. La dinámica de las publicaciones y los tipos de QA de informes aumentaron con el tiempo en paralelo con un mayor número de biosimilares con licencia y parece verse afectada por el desarrollo de pautas regulatorias en 2012-2015.La disponibilidad de una evaluación completa, públicamente accesible (acceso abierto) e imparcial de biosimilaridad de QA podría contribuir a una mayor confianza y aceptación de biosimilares en la práctica clínica. Eur J Pharm Sci, 30 de julio de 2020
Diclofenac: Impacto de los cambios en el etiquetado de EMA en el inicio, la interrupción y el cambio a otros medicamentos para el dolor en Escocia, Inglaterra, Dinamarca y los Países Bajos
20 febrero 2020
La acción reguladora se asoció con reducciones significativas en el inicio general de diclofenac que variaron según el país y el tipo de exposición. No hubo impacto en la interrupción e impacto variable en el cambio. Pharmacoepidemiol Drug Saf. 3 de enero de 2020

Defendiendo la transparencia en la agencia reguladora de medicamentos de Europa
14 enero 2020
