Farmacología

Recomendaciones de la EMA y el ECDC sobre ciclos de vacunación heteróloga contra COVID-19
22 diciembre 2021
El enfoque de "mezclar y combinar" se puede utilizar tanto para los cursos iniciales como para los refuerzos. EMA 7 de diciembre de 2021

Recomendaciones de la EMA sobre terceras dosis y dosis de refuerzo de las vacunas frente a la COVID-19 Comirnaty (BioNTech/Pfizer) y Spikevax (Moderna)
05 octubre 2021
La agencia europea indica que podrían administrarse terceras dosis de las vacunas Comirnaty (BioNTech/Pfizer) y Spikevax (Moderna) a personas trasplantadas e inmunocomprometidas. También se podría considerar una dosis de refuerzo de Comirnaty a personas de más de 18 años que hayan recibido una segunda dosis hace, al menos, seis meses. Se consideran terceras dosis las que se administran a personas trasplantadas o inmunocomprometidas y dosis de refuerzo las que se administran a personas con un sistema inmune normal. AEMPS, 4 de octubre de 2021
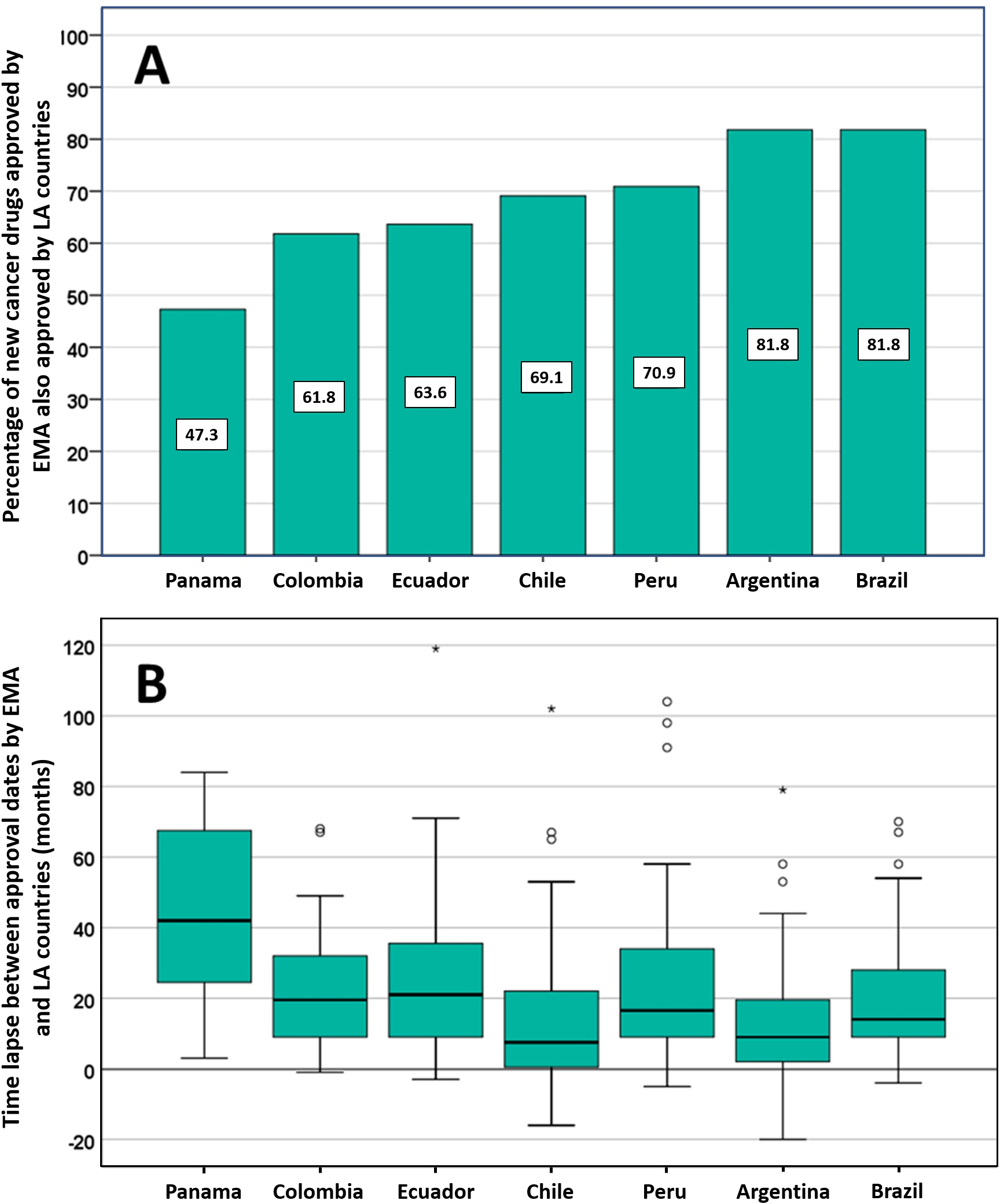
Posible impacto negativo de las decisiones de Agencias reguladoras reputadas sobre el estado de aprobación de nuevos medicamentos contra el cáncer en los países de América Latina
14 julio 2021
Los países de América Latina siguen aprobando nuevos medicamentos contra el cáncer, a menudo basándose en ensayos clínicos mal realizados que miden criterios de valoración sustitutos. La EMA y otros reguladores de renombre deben ser conscientes de que sus decisiones regulatorias pueden influir directamente en las decisiones relativas a la autorización de comercialización, los presupuestos de salud y la atención del paciente en otros lugares. PLoS ONE 13 de julio de 2021
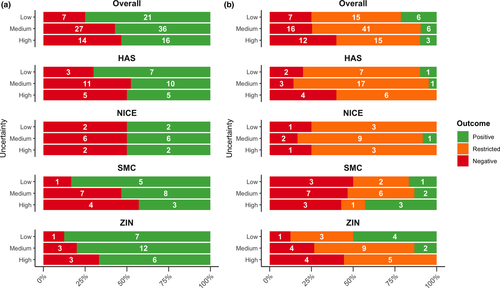
Asociación entre las incertidumbres identificadas por la Agencia Europea de Medicamentos y la toma de decisiones nacional sobre el reembolso por parte de las agencias de ETS
18 mayo 2021
En conclusión, la alta incertidumbre identificada por la EMA se asoció con evaluaciones de efectividad relativa (EER) negativas y recomendaciones de reembolso generales negativas. Para reducir la incertidumbre y, en última instancia, facilitar el acceso eficiente de los pacientes, los reguladores, las agencias de ETS y otras partes interesadas deben analizar cómo se deben sopesar y abordar las incertidumbres en las primeras etapas del ciclo de vida del fármaco de los tratamientos innovadores. Clin Transl Sci 30 de marzo de 2021

Aprobación de medicamentos oncológicos por vía acelerada: discrepancias entre la FDA y las agencias europeas
23 febrero 2021
