Farmacología

EMA rechaza la autorización de comercialización de molnupiravir (Lagevrio)
27 febrero 2023
La Agencia Europea de Medicamentos ha recomendado la denegación de la autorización de comercialización de molnupiravir, medicamento destinado al tratamiento de la COVID-19 en adultos. La Agencia emitió su dictamen el 23 de febrero de 2023. La empresa que solicitó la autorización, Merck Sharp & Dohme B.V., puede solicitar un nuevo examen del dictamen dentro de los 15 días posteriores a la recepción del dictamen. EMA, 24 de febrero de 2023
Codeína con ibuprofeno: EMA agrega advertencia sobre daños renales y gastrointestinales graves
17 octubre 2022
El Comité de Farmacovigilancia para la Evaluación de Riesgos (PRAC) de la Agencia Europea de Medicamentos (EMA), ha recomendado un cambio en la información del producto para los medicamentos combinados de codeína e ibuprofeno para incluir una advertencia de daños graves, incluida la muerte, especialmente cuando se toman durante períodos prolongados en dosis superiores a las recomendadas. EMA, 30 de septiembre de 2022

Declaración sobre los fundamentos científicos que respaldan la intercambiabilidad de los medicamentos biosimilares en la Unión Europea (UE)
21 septiembre 2022
Los expertos de la UE en medicamentos biosimilares (Grupo de Trabajo de Medicamentos Biosimilares o BMWP) y el Grupo de Trabajo de Biosimilares de los Jefes de Agencias de Medicamentos (HMA) han redactado una declaración conjunta que explica los fundamentos para considerar biosimilares aprobados en la UE como intercambiables desde una perspectiva científica. EMA, 19 de septiembre de 2022
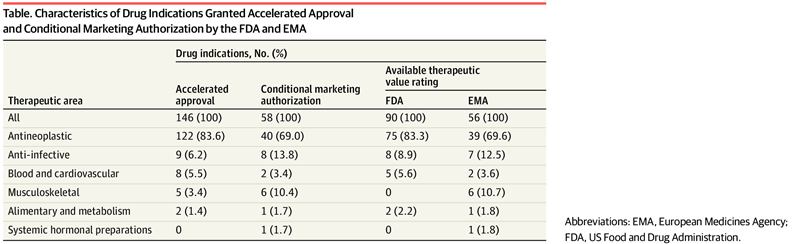
Valor terapéutico de los medicamentos con aprobación acelerada o autorización de comercialización condicional en los EE. UU. y Europa de 2007 a 2021
23 agosto 2022
En este estudio de cohortes, entre las nuevas indicaciones de medicamentos aprobadas a través de las vías de aprobación acelerada o autorización de comercialización condicional en los EE. UU. y Europa de 2007 a 2021, el 38,9 % y el 37,5 %, respectivamente, demostraron un alto valor terapéutico. Una proporción sustancialmente menor de indicaciones de cáncer que de indicaciones no oncológicas fueron calificadas como de alto valor terapéutico. Los encargados de formular políticas y los reguladores deben aumentar la aplicación de la finalización oportuna del estudio posterior a la aprobación para los medicamentos que califican para estas vías. JAMA Health Forum. 19 de agosto de 2022
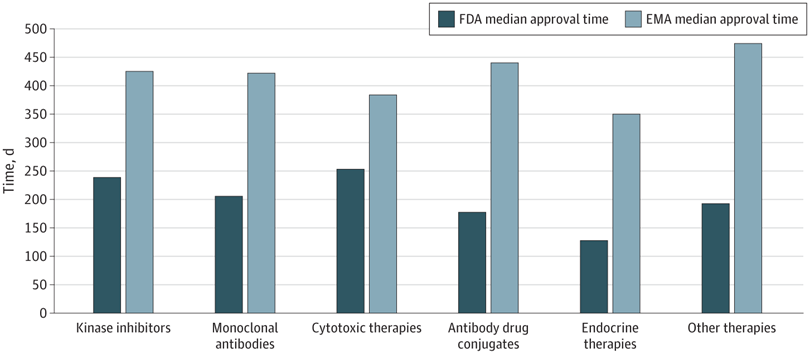
Plazos de aprobación de la terapia del cáncer, velocidad de revisión y publicación de ensayos de registro pivotales en los EE. UU. y Europa, 2010-2019
16 junio 2022
