Farmacología

Realización y presentación de informes de ensayos con leches de fórmula: revisión sistemática
14 octubre 2021
Los resultados muestran que los ensayos de leches de fórmulas carecen de independencia o transparencia, y los resultados publicados están sesgados por informes selectivos. BMJ, 14 de octubre de 2021
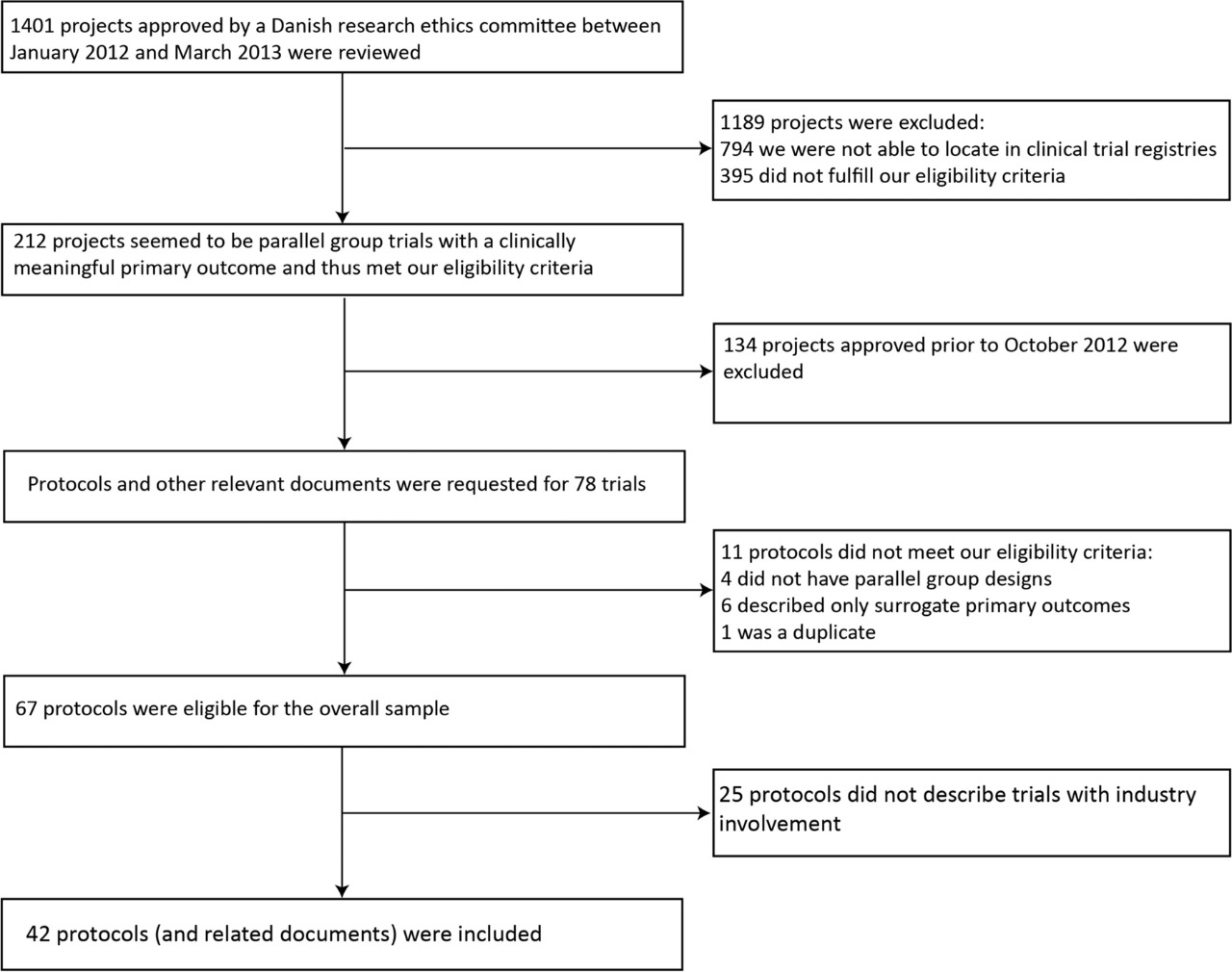
¿Se restringe el acceso de los investigadores a los datos de los ensayos clínicos y los derechos de publicación? ¿Se informa a los posibles participantes del ensayo sobre esto? Comparación de los protocolos de los ensayos y los materiales de consentimiento informado
30 septiembre 2021
Las restricciones de publicación son comunes y los datos suelen ser propiedad de socios de la industria. Esto rara vez se comunica a los participantes del ensayo. Tales limitaciones pueden contribuir a problemas con la notificación selectiva de resultados. Los pacientes deben estar completamente informados sobre estos aspectos de la realización del ensayo. BMC Medical Ethics 28 de agosto de 2021
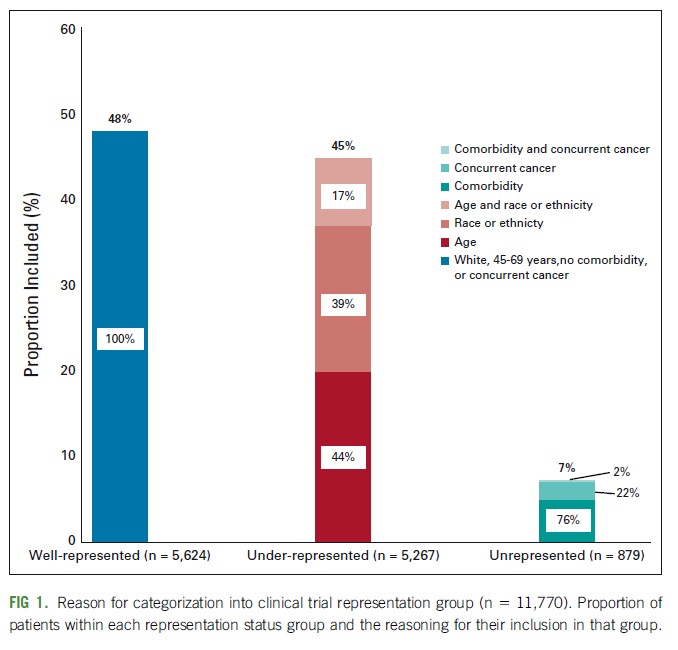
Supervivencia en el mundo real: análisis nacional de pacientes tratadas por cáncer de mama en estadio temprano
28 septiembre 2021
Más de la mitad de los pacientes estaban infrarrepresentados o no estaban representados en los ensayos clínicos debido a la edad, la comorbilidad o la raza. Algunos de estos grupos experimentaron una supervivencia más pobre en comparación con los que estaban bien representados en los ensayos. Los investigadores deben asegurarse de que los participantes del estudio reflejen la población de la enfermedad para respaldar la toma de decisiones basada en evidencia para todas las personas con cáncer. JCO Oncology Practice,24 de septiembre de 2021
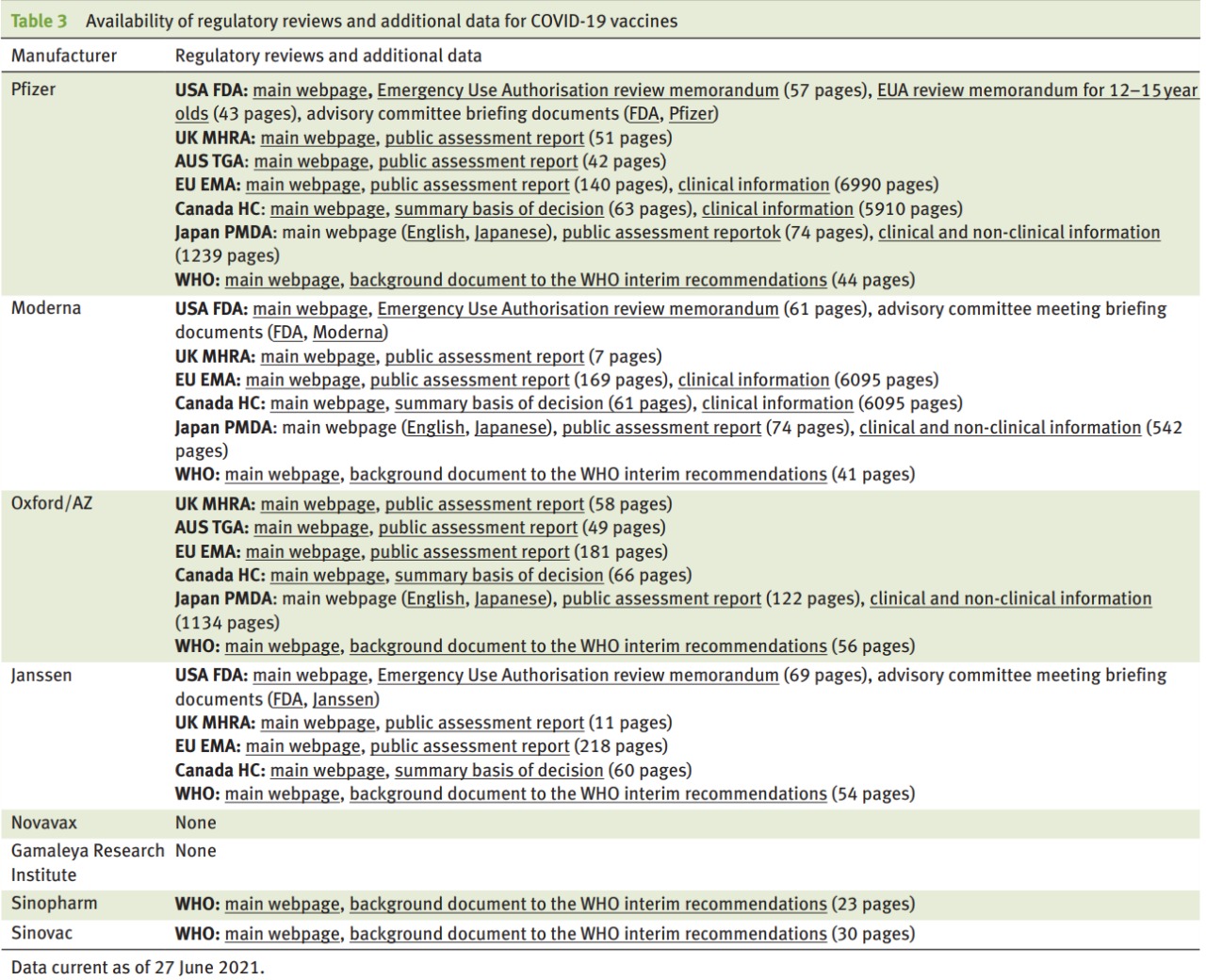
Transparencia de los ensayos de la vacuna COVID-19: decisiones sin datos
23 agosto 2021
La transparencia del ensayo debe comenzar temprano y ser continua. Los protocolos del ensayo deben publicarse una vez finalizados, antes de que se informen los resultados del ensayo, y deben ir acompañados de la publicación de los documentos y datos del ensayo antes de que los médicos y el público tomen decisiones sobre el uso del producto. BMJ Evidence-Based Medicine, 9 de agosto de 2021

Transparencia de los ensayos clínicos e intercambio de datos entre las empresas biofarmacéuticas y papel del tamaño de la empresa, ubicación y tipo de producto: un análisis descriptivo transversal
03 agosto 2021
