Farmacología

Informe público de los resultados de los ensayos clínicos como una responsabilidad ética hacia los participantes: estudio cualitativo
28 marzo 2023
Las opiniones de los participantes del ensayo, los investigadores del ensayo y otras personas relacionadas con la investigación de ensayos clínicos en Canadá sugieren que los investigadores tienen la obligación de informar públicamente los resultados de los ensayos clínicos a los participantes y que informar los resultados es necesario para cumplir con el consentimiento informado. BMJ Open. 21 de marzo de 2023

Evaluación de los comparadores empleados en los estudios pivotales de nuevos medicamentos e indicaciones
21 marzo 2023
Aproximadamente uno de cada cuatro nuevos medicamentos o indicaciones carece de una comparación suficiente en el momento de empezar a ser utilizado en la práctica clínica. La proporción no mejora a lo largo de los últimos 10 años. Las agencias reguladoras deben ser más exigentes en la selección del comparador para los ensayos clínicos pivotales, por cuestiones éticas y sanitarias. Rev. OFIL·ILAPHAR, marzo de 2023

Renuncias al consentimiento informado en investigaciones con participantes competentes y la Declaración de Helsinki
15 marzo 2023
Si bien los CEI de cualquier país tienen derecho a aprobar modificaciones y renuncias al consentimiento en cualquier ensayo aunque la normativa nacional no lo contemple, la próxima revisión de la Declaración de Helsinki, debería considerar incluir esta posibilidad para la investigación en participantes competentes . Idealmente, la redacción debería ser como la de las directrices de CIOMS, ya que incluye los requisitos clave relevantes a considerar y es lo suficientemente breve para estar en línea con la forma en que están redactados los elementos de la Declaración de Helsinki. Esto permitirá a los investigadores clínicos de todo el mundo el respaldo ético explícito para proponer estas exenciones en ciertos tipos de investigación. Eur J Clin Pharmacol, 8 de marzo de 2023

Características de los ensayos clínicos en oncología que se publican con el apoyo de redactores médicos
02 febrero 2023
Los ensayos que utilizaron redactores médicos tenían más probabilidades de informar criterios de valoración alternativos, como la supervivencia libre de progresión, y de tener conclusiones favorables, aunque esta última asociación no fue significativa luego de ajustar por la fase del ensayo, aleatorización y financiación del estudio. JAMA Network Open, 1º de febrero de 2023.
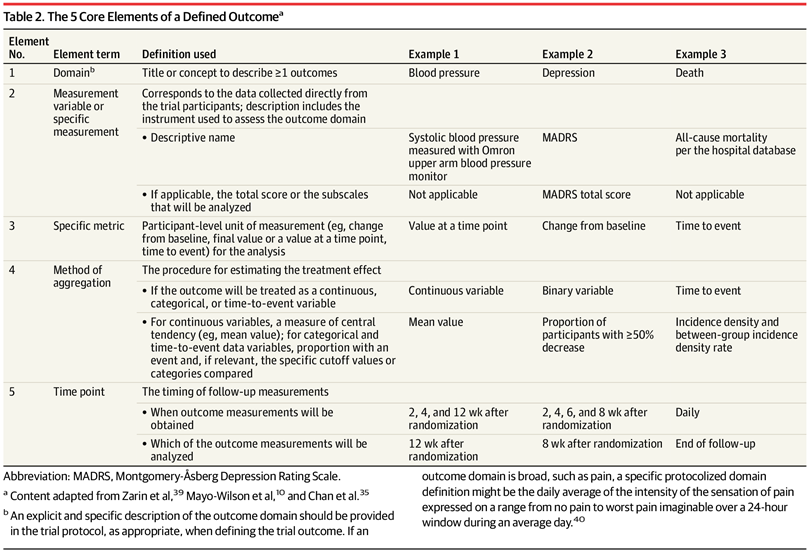
Directrices para la notificación de resultados en informes de ensayos. Extensión CONSORT-Outcomes 2022
14 diciembre 2022
