Farmacología
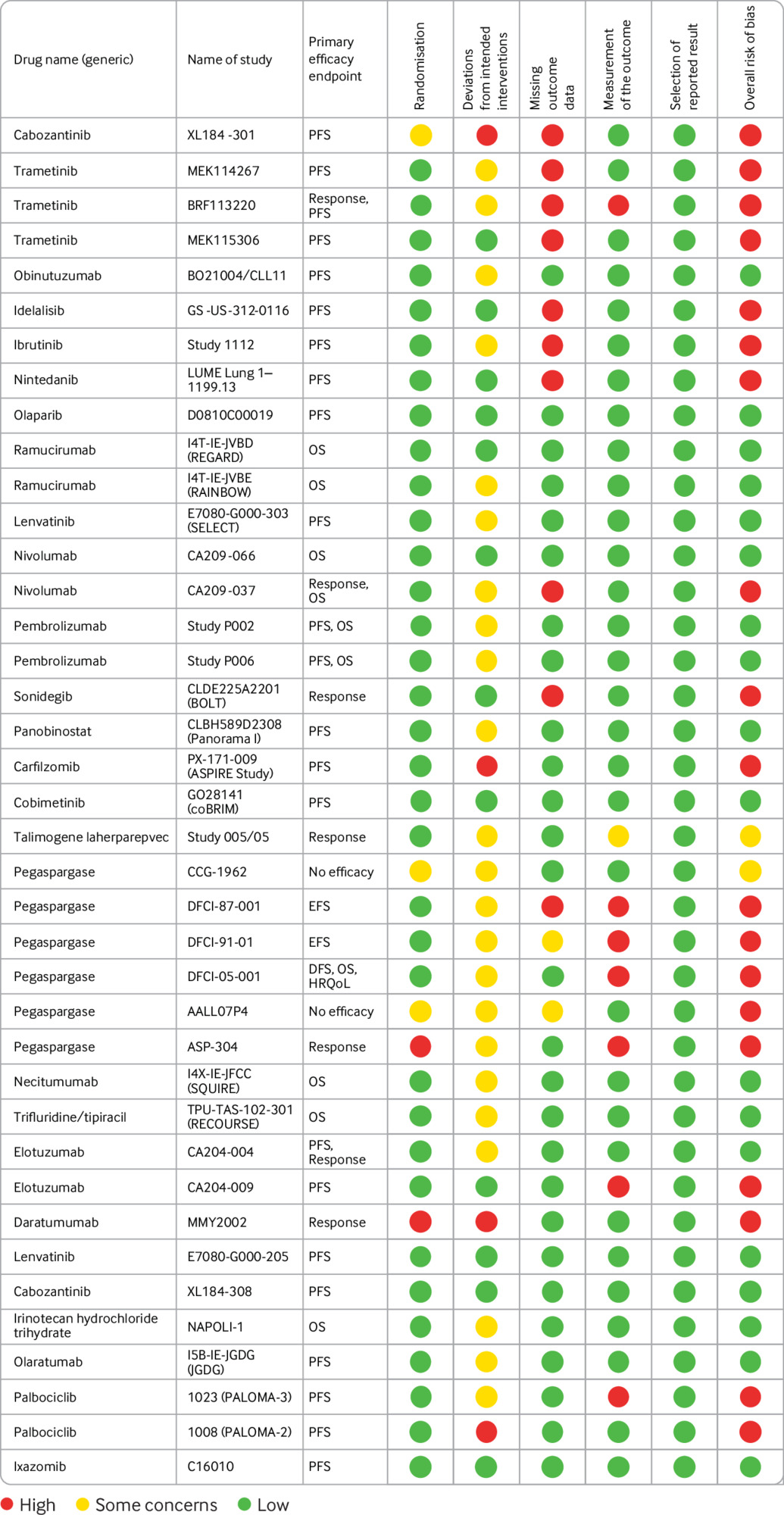
Características de diseño, riesgo de sesgo e informes de ensayos controlados aleatorios que respaldan las aprobaciones de medicamentos contra el cáncer por la Agencia Europea de Medicamentos, 2014-16
19 septiembre 2019
BMJ,18 de septiembre de 2019 La mayoría de los estudios pivotales que formaron la base de la aprobación EMA de nuevos medicamentos contra el cáncer entre 2014 y 2016 fueron ensayos controlados aleatorios. Sin embargo, se consideró que casi la mitad de ellos tenían un alto riesgo de sesgo en función de su diseño, conducta o análisis, algunos de los cuales podrían ser inevitables debido a la complejidad de los ensayos de cáncer. Los documentos reglamentarios y la literatura científica tenían lagunas en sus informes. Las publicaciones en revistas no reconocieron las limitaciones clave de la evidencia disponible identificada en los documentos reglamentarios.

Valor terapéutico añadido de los nuevos medicamentos aprobados en Brasil desde 2004 a 2016
16 julio 2019
Cad. Saúde Pública, mayo de 2019 Pocos medicamentos terapéuticamente innovadores accedieron al mercado brasileño y de éstos sólo una pequeña parte fueron aprobados para que fueran cubiertos por el SUS. Nuestros resultados sugieren una divergencia entre las necesidades públicas de salud, investigación & desarrollo (I&D) y los procedimientos para la autorización de medicamentos.

Registros de pacientes: un recurso infrautilizado para la evaluación de medicamentos
16 julio 2019
Drug Saf, 13 de julio de 2019 Estas son las primeras propuestas explícitas, desde una perspectiva regulatoria, sobre métodos operativos para aumentar el uso de registros de pacientes en la regulación de medicamentos. Se aplican a los titulares de registros, pacientes, reguladores, titulares de autorizaciones de comercialización y partes interesadas de la asistencia sanitaria en general, y su implementación facilitaría enormemente el uso de estas valiosas fuentes de datos en la toma de decisiones regulatorias.

Estudios de postcomercialización acordados de nuevos medicamentos y productos biológicos aprobados por la FDA
21 junio 2019
BMC Medicine 17 de junio de 2019Si bien solo el 15% de los compromisos posteriores a la comercialización acordados por las compañías farmacéuticas en el momento de la aprobación de la FDA fueron para nuevos ensayos clínicos, estos ensayos casi siempre se registraron con resultados informados en ClinicalTrials.gov. Sin embargo, solo la mitad se publicó y, a pesar de los requisitos de informes públicos de la FDA, la información reciente sobre el estado a menudo no estaba disponible para los estudios 506B.

Valor terapéutico y precio de los nuevos fármacos comercializados en Argentina: ¿valen lo que cuestan?
25 marzo 2019
