Farmacología

Regulación de la Información sobre Prescripción de Medicamentos en América Latina y el Caribe
08 abril 2022
Se evidenció un bajo nivel de armonización entre las regulaciones de estos países en cuanto al contenido y manejo (por ejemplo, si se requiere o no un prospecto físico, si está sujeto a notificación o aprobación) de la ficha técnica de los medicamentos de uso humano. Además, hay una falta visible de estandarización de los conceptos para referirse a un documento específico (por ejemplo, prospecto para profesionales de la salud, prospecto de información para el paciente e información técnica del medicamento) y en el contenido mismo. Ther Innov Regul Sci, 5 de abril de 2022
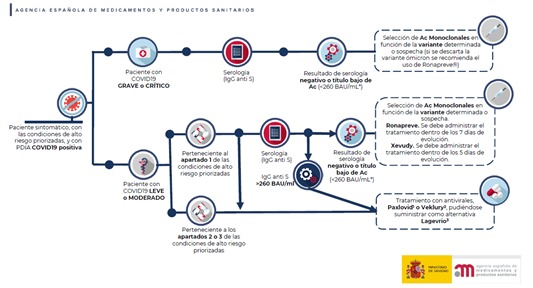
Criterios para valorar la administración de las nuevas alternativas terapéuticas antivirales frente a la infección por SARS-CoV-2
05 abril 2022
En estos momentos hay una limitada disponibilidad de las nuevas alternativas terapéuticas antivirales frente a la infección por SARS-CoV-2. Esto hace necesario establecer unos criterios de priorización en el acceso precoz a los mismos.AEMPS, 4 de abril de 2022

Influencia de los avisos de seguridad de medicamentos en la utilización de medicamentos
24 enero 2022
En este análisis de series de tiempo interrumpido internacional y metanálisis, se encontró que entre los avisos de seguridad emitidos sobre una amplia gama de medicamentos durante 2009–2015 en 4 países (Canadá, Dinamarca, el Reino Unido y los EE. UU.), la asociación de los avisos con cambios en la utilización del medicamento fue variable y la asociación promedio fue modesta. BMJ Quality & Safety, 20 de enero de 2022

Aprobación de medicamentos por la FDA y la ética de la desesperación
29 octubre 2021
Cuando los pacientes tienen un diagnóstico de desesperación que los deja frente a una enfermedad que limita la vida sin buenas opciones de tratamiento, ¿qué papel debe desempeñar su voluntad de probar un medicamento de beneficio no probado en la toma de decisiones regulatorias? En este punto de vista, argumentamos que las voces de los pacientes deben integrarse en el proceso de aprobación de medicamentos, pero sin tal deferencia que la FDA abdique de su responsabilidad de garantizar que los medicamentos sean seguros y efectivos. JAMA Intern Med, 25 de octubre de 2021

La FDA autoriza una dosis de refuerzo de la vacuna contra el COVID-19 de Pfizer-BioNTech para determinadas poblaciones
24 septiembre 2021
