Farmacología

Cumplimiento de Compromisos y Requisitos de Postcomercialización de Nuevos Medicamentos Aprobados por la FDA, 2013-2016
28 octubre 2022
Los retrasos en la entrega de la información de seguridad y eficacia posterior a la aprobación necesaria para los medicamentos nuevos tienen implicaciones para la atención del paciente, en particular para las preguntas clínicas no resueltas y las poblaciones excluidas de los ensayos previos a la aprobación. Para abordar este problema, el Congreso debería considerar otorgar a la FDA más autoridad, como la capacidad de instituir sanciones monetarias civiles automáticas cuando los fabricantes de productos farmacéuticos no cumplan con sus requisitos y compromisos a tiempo. JAMA Intern Med. 3 de octubre de 2022

Qué impulsa la acumulación de ensayos clínicos de cáncer? Un análisis empírico de los estudios que condujeron a la autorización de la FDA (2015-2020)
12 octubre 2022
En este estudio transversal, la línea de terapia, la fase de estudio y el fabricante fueron los únicos factores asociados con la tasa de acumulación. Estos hallazgos sugieren que muchos factores propuestos para la rápida acumulación de ensayos no están asociados con mayores tasas de inscripción. BMJ Open, 7 de octubre de 2022

Características y confirmación posterior de las alertas de seguridad notificadas a la FDA
06 octubre 2022
La mayoría de las posibles señales de seguridad identificadas condujeron a la adopción de medidas reglamentarias por parte de la FDA. Sin embargo, solo un tercio de las acciones regulatorias fueron corroboradas por investigaciones publicadas y ninguna por evaluaciones públicas de la Iniciativa Sentinel. Estos hallazgos sugieren que, o bien la FDA está tomando medidas reglamentarias basadas en pruebas que no se han puesto a disposición del público, o que podrían ser necesarias evaluaciones de seguridad más exhaustivas cuando se identifiquen posibles señales de seguridad. British Medical Journal, 5 de octubre de 2022.
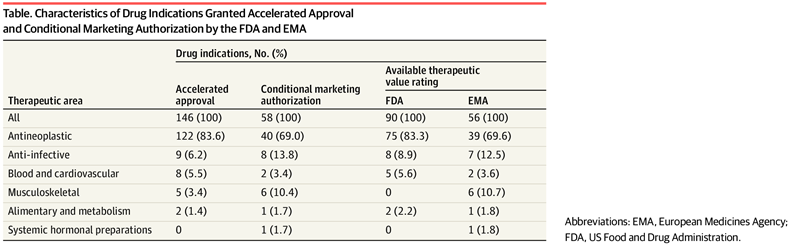
Valor terapéutico de los medicamentos con aprobación acelerada o autorización de comercialización condicional en los EE. UU. y Europa de 2007 a 2021
23 agosto 2022
En este estudio de cohortes, entre las nuevas indicaciones de medicamentos aprobadas a través de las vías de aprobación acelerada o autorización de comercialización condicional en los EE. UU. y Europa de 2007 a 2021, el 38,9 % y el 37,5 %, respectivamente, demostraron un alto valor terapéutico. Una proporción sustancialmente menor de indicaciones de cáncer que de indicaciones no oncológicas fueron calificadas como de alto valor terapéutico. Los encargados de formular políticas y los reguladores deben aumentar la aplicación de la finalización oportuna del estudio posterior a la aprobación para los medicamentos que califican para estas vías. JAMA Health Forum. 19 de agosto de 2022
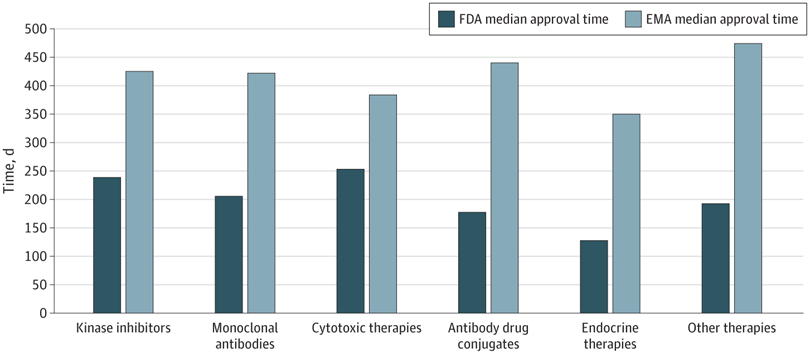
Plazos de aprobación de la terapia del cáncer, velocidad de revisión y publicación de ensayos de registro pivotales en los EE. UU. y Europa, 2010-2019
16 junio 2022
