Farmacología
Consecuencias globales de la aprobación acelerada de medicamentos contra el cáncer por parte de la FDA de EE. UU.
30 marzo 2022
Se han descrito previamente varios desafíos y limitaciones de esta vía para el entorno regulatorio y clínico de EE. UU. En este trabajo se discute las consecuencias que a menudo se pasan por alto de la vía de aprobación acelerada para la oncología global. Lancet Oncol, febrero de 2022

¿Deberían las autoridades reguladoras aprobar medicamentos basados en desenlaces subrogados?
17 septiembre 2021
La controversia del aducanumab es el último ejemplo de criterios de valoración sustitutos que no predicen resultados clínicamente importantes. Sin embargo, como informan Jeanne Lenzer y Shannon Brownlee, se utilizan cada vez más como la base para las aprobaciones de medicamentos. BMJ 16 de septiembre de 2021
FDA permite que los medicamentos sin un beneficio clínico comprobado permanezcan durante años en la vía acelerada
30 julio 2021
"El proceso actual, que permite que los medicamentos estén en el mercado con una base de evidencia tan baja, envía señales equivocadas a otras compañías farmacéuticas, que asumirán que también pueden obtener aprobación con poca evidencia". BMJ 30 de julio de 2021

Críticas a la aprobación acelerada por la FDA de un medicamento para el Alzheimer
19 julio 2021
El aducanumab se aprobó por su efecto sobre las placas de amiloide cerebral, sin verificar si el tratamiento es beneficioso para los pacientes. Se plantea que este aspecto crucial recién se evaluará en investigaciones posteriores a la comercialización. La vía de aprobación acelerada de la FDA se ve seriamente cuestionada. JAMA Internal Medicine, 13 de julio de 2021
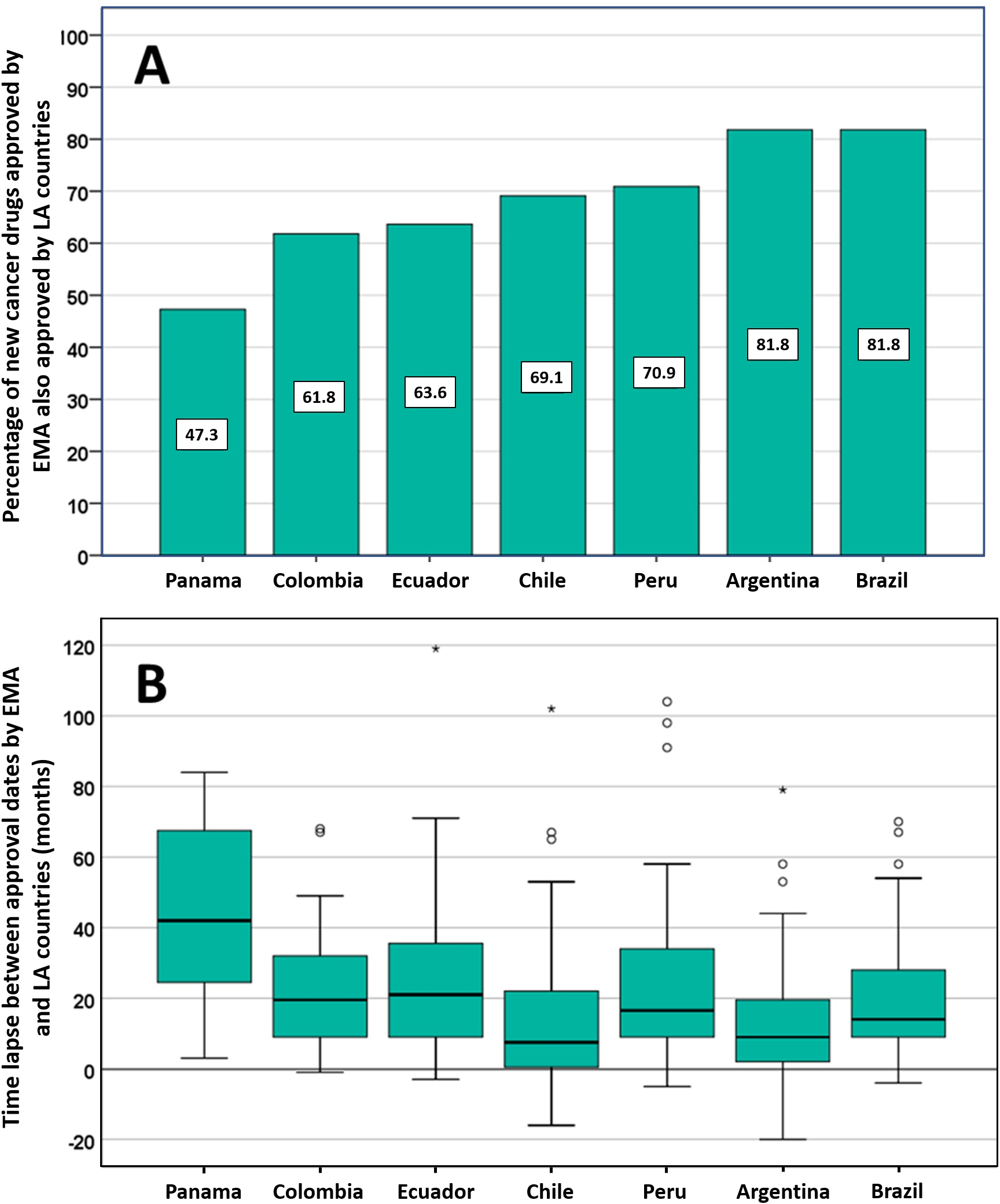
Posible impacto negativo de las decisiones de Agencias reguladoras reputadas sobre el estado de aprobación de nuevos medicamentos contra el cáncer en los países de América Latina
14 julio 2021
