Farmacología
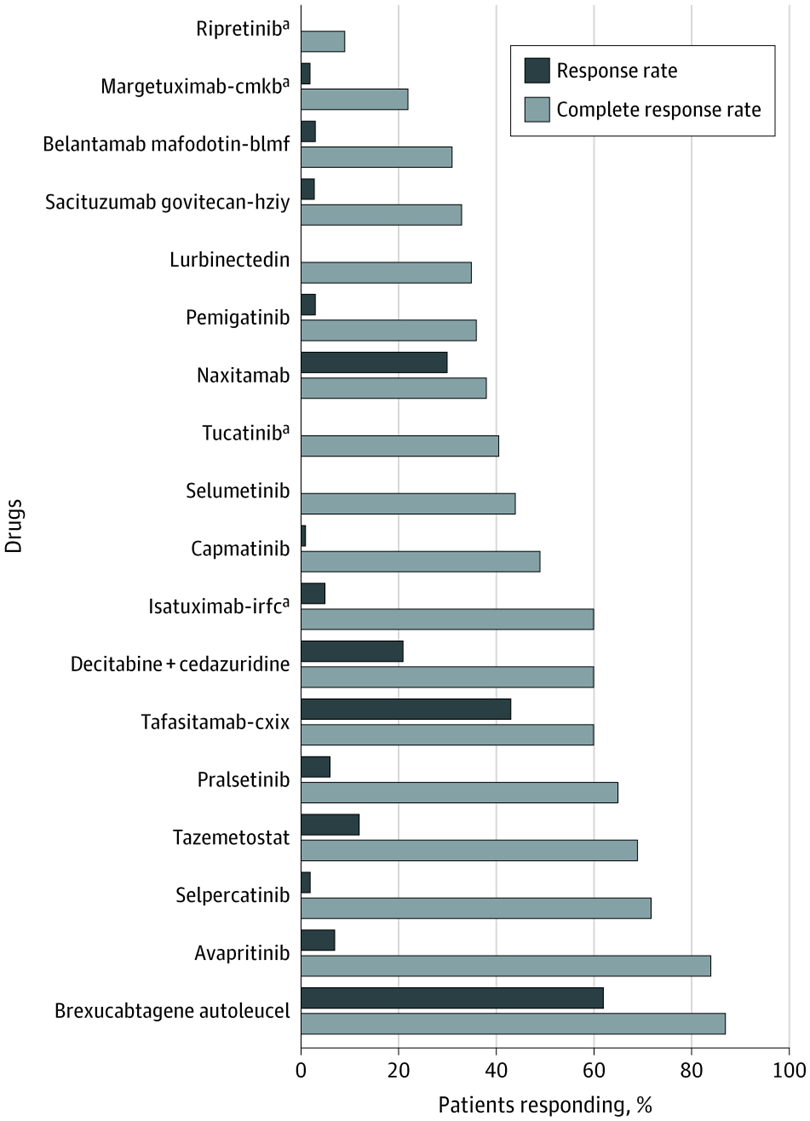
Evaluación de nuevas entidades moleculares aprobadas para el tratamiento del cáncer en 2020
02 junio 2021
La FDA aprobó más nuevas entidades moleculares (NEM) para el cáncer en 2020 que en 2019. Sin embargo, la mayoría de las NEM aprobadas se basaron en criterios de valoración sustitutos con efectos inciertos sobre la supervivencia y la calidad de vida.5 La mayoría de las aprobaciones se basaron en ensayos clínicos no controlados de un solo brazo y requerirán pruebas de eficacia posteriores a la comercialización. JAMA Netw Open, 28 de mayo de 2021
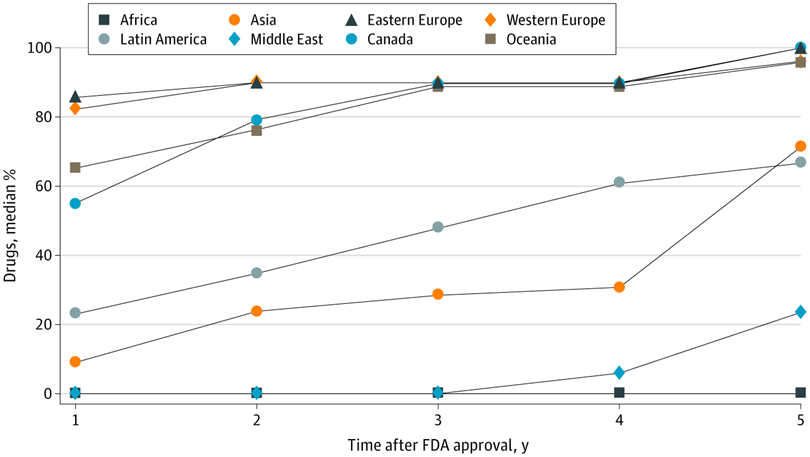
Evaluación de ensayos de medicamentos en países de ingresos altos, medianos y bajos y disponibilidad comercial local de medicamentos recientemente aprobados
17 mayo 2021
Estos hallazgos sugieren que existen brechas sustanciales entre dónde se prueban los medicamentos aprobados por la FDA y dónde finalmente están disponibles para los pacientes, lo que genera inquietudes sobre la distribución equitativa de los beneficios de la investigación a nivel de la población. JAMA Netw Open. 5 de mayo de 2021

Aprobación de medicamentos oncológicos por vía acelerada: discrepancias entre la FDA y las agencias europeas
23 febrero 2021
Una parte sustancial de los fármacos oncológicos aprobados por la FDA por vía acelerada no fueron evaluados por las autoridades regulatorias europeas, o se les negó o retiró la autorización de comercialización. Además, muchas de las aprobaciones en el Reino Unido quedaban sujetas a acuerdos de reducción de precios. JAMA Internal Medicine, 22 de febrero de 2021.

Propuesta de retirar del mercado un fármaco aprobado por procedimiento acelerado
10 diciembre 2020
El Centro de Evaluación e Investigación de Medicamentos de la FDA ha recomendado retirar del mercado la inyección de caproato de hidroxiprogesterona utilizada como tratamiento preventivo de la recurrencia de parto prematuro, que fuera aprobada en 2011 por vía rápida en base a desenlaces surrogados, debido a que los resultados postcomercialización no mostraron la eficacia esperada. New England Journal of Medicine, 10 de diciembre de 2020.

Aprobaciones de nuevos medicamentos y productos biológicos en 2019: un análisis sistemático de los datos de la experiencia del paciente en los paquetes de aprobación de medicamentos y el etiquetado de la FDA
04 diciembre 2020
