Farmacología
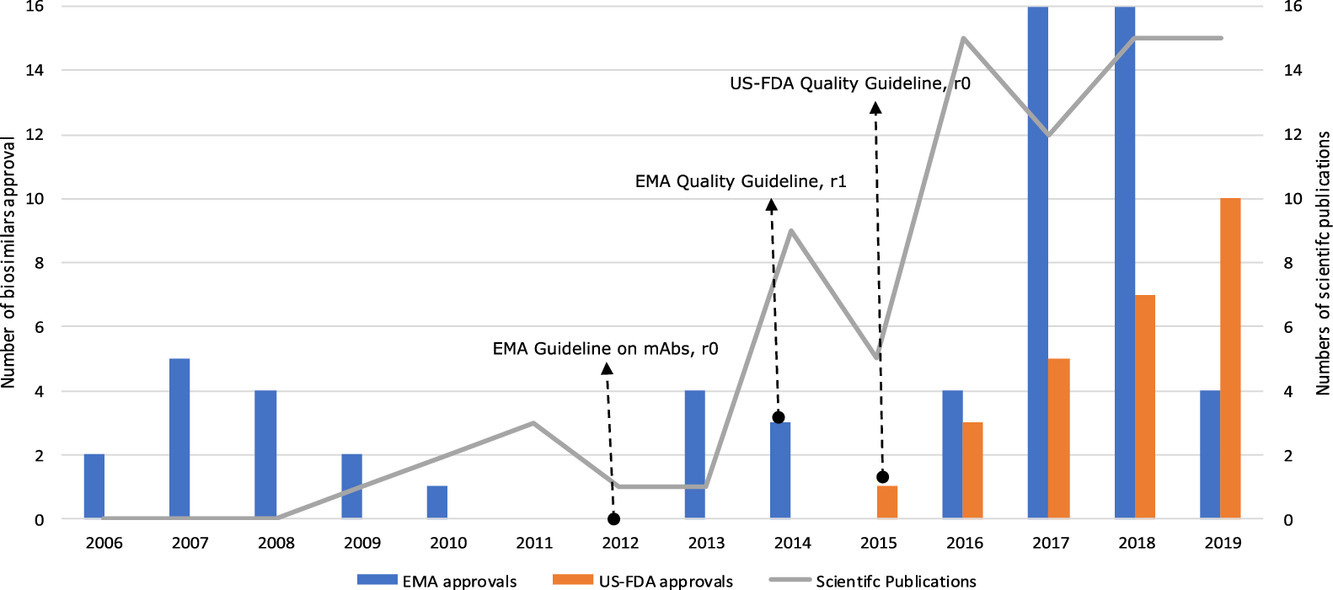
Informe de atributos de calidad en publicaciones científicas que presentan evaluaciones de biosimilaridad de biosimilares (previstos): una revisión sistemática de la literatura
31 julio 2020
Las evaluaciones de biosimilaridad de los atributos de calidad (QA) se han publicado en publicaciones científicas revisadas por pares para aproximadamente el 60% de los biosimilares aprobados. La dinámica de las publicaciones y los tipos de QA de informes aumentaron con el tiempo en paralelo con un mayor número de biosimilares con licencia y parece verse afectada por el desarrollo de pautas regulatorias en 2012-2015.La disponibilidad de una evaluación completa, públicamente accesible (acceso abierto) e imparcial de biosimilaridad de QA podría contribuir a una mayor confianza y aceptación de biosimilares en la práctica clínica. Eur J Pharm Sci, 30 de julio de 2020

Limitaciones en los ensayos clínicos que conducen a la aprobación de medicamentos contra el cáncer por parte de la FDA
17 junio 2020
Dos tercios de los medicamentos contra el cáncer están aprobados en base a ensayos clínicos con limitaciones en al menos 1 de 4 dominios esenciales. Los esfuerzos para minimizar estas limitaciones en el momento del diseño del ensayo clínico son esenciales para garantizar que los nuevos medicamentos contra el cáncer realmente mejoren los resultados de los pacientes sobre los estándares actuales. JAMA Intern Med. 15 de junio de 2020.

Combinando las redes sociales y el sistema de informes de eventos adversos de la FDA para detectar reacciones adversas a los medicamentos
08 mayo 2020
Este estudio utiliza un método computacional (modelo bayesiano empírico) para combinar las señales de seguridad de los medicamentos de un sistema de informe espontáneo con los de las redes sociales.La precisión de la detección de señales utilizando las redes sociales se puede mejorar combinando las señales con las de los sistemas de informes espontáneos.La evaluación del sistema combinado y las fuentes individuales se basó en un estándar de referencia bastante grande, y los resultados de este estudio arrojan luz sobre el papel potencial de los datos de Twitter en la farmacovigilancia. Drug Saf , 8 de mayo de 2020
Evaluación de ensayos clínicos que respaldan la aprobación de la Administración de Alimentos y Medicamentos de los EE. UU. de nuevos agentes terapéuticos, 1995-2017
24 abril 2020
Este estudio encontró cambios en la evidencia que respalda la aprobación de nuevos medicamentos y productos biológicos por la FDA. Las aprobaciones más recientes se basaron en menos ensayos fundamentales, que, cuando se agregaron por indicación, tenían diseños menos rigurosos pero duraciones de ensayos más largas, Estos cambios sugieren que es necesario evaluar, de manera continua, la seguridad y la eficacia terapéutica después de la aprobación. JAMA Netw Open 21 de abril de 2020;

Evaluación de ensayos clínicos que respaldan la aprobación de la Administración de Alimentos y Medicamentos de los EE. UU. de nuevos agentes terapéuticos, 1995-2017
22 abril 2020
