Farmacología

Estudios de postcomercialización acordados de nuevos medicamentos y productos biológicos aprobados por la FDA
21 junio 2019
BMC Medicine 17 de junio de 2019Si bien solo el 15% de los compromisos posteriores a la comercialización acordados por las compañías farmacéuticas en el momento de la aprobación de la FDA fueron para nuevos ensayos clínicos, estos ensayos casi siempre se registraron con resultados informados en ClinicalTrials.gov. Sin embargo, solo la mitad se publicó y, a pesar de los requisitos de informes públicos de la FDA, la información reciente sobre el estado a menudo no estaba disponible para los estudios 506B.
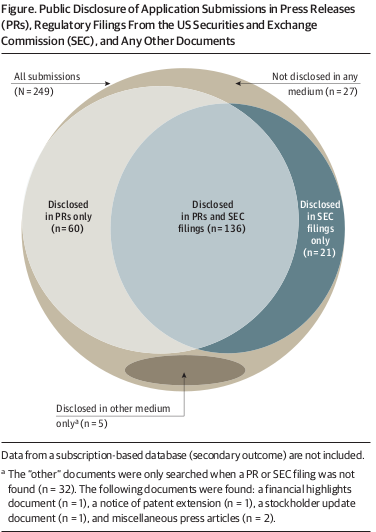
Divulgación pública de la presentación de solicitudes de nuevos medicamentos y productos biológicos terapéuticos ante la FDA
05 junio 2019
JAMA Intern Med 3 de junio de 2019. casi el 90 % de las presentaciones presentada entre 2010 y 2016 fue divulgada por las propias compañías farmacéuticas en forma de comunicados de prensa. archivos presentados ante la Comisión de Valores e Intercambio, o ambos, y generalmente dentro de una semana de la presentación de la solicitud a la FDA.

FDA advierte a las mujeres sobre los riesgos del uso de suplementos con vinpocetina
05 junio 2019
FDA, 3 de junio de 2019 riesgo de efectos adversos en el feto, incluido el aborto espontáneo en mujeres en edad fértil

Uno de cada cinco fármacos oncológicos aprobados por la FDA por vía acelerada mostró beneficio en la sobrevida
04 junio 2019
Sólo 19 de 93 medicamentos para el cáncer aprobados por vía acelerada mostró en los estudios post comercialización que logra prolongar la sobrevida de los pacientes. JAMA, 28 de mayo de 2019

Elevada concentración en sangre de los ingredientes activos de protectores solares aplicados en condiciones de uso máximo
17 mayo 2019
