Farmacología

FDA presenta una nueva propuesta de norma para asegurar que los protectores solares sean seguros y eficaces
25 febrero 2019
Comunicado de Prensa de la FDA, 21 de febrero de 2019 Según la norma propuesta emitida por la agencia, solo dos de los dieciséis ingredientes activos comercializados actualmente utilizados en filtros solares (óxido de zinc y dióxido de titanio) son "generalmente reconocidos como seguros y efectivos" (GRASE). Dos ingredientes, PABA y salicilato de trolamina, no son GRASE debido a problemas de seguridad, y no hay datos suficientes sobre los doce restantes. Los productos que combinan un protector solar con repelente de insectos no deben ser considerados GRASE,

Febuxostat (Uloric): FDA agrega una advertencia de recuadro para alertar del aumentao del riesgo de muerte con este medicamento para la gota
22 febrero 2019
FDA 21 de febrero de 2019 FDA concluyó que existe un mayor riesgo de muerte con Uloric (febuxostat) en comparación con otro medicamento para la gota, el alopurinol. Esta es una actualización una comunicación previa : la FDA evalúa un mayor riesgo de muerte relacionada con el corazón y muerte por todas las causas con el medicamento para la gota febuxostat (Uloric) emitido el 15 de noviembre de 2017.

Coordinando el cumplimiento de reealización de ensayos clínicos para confirmar la seguridad y eficacia de los medicamentos: resolución de incertidumbres
10 enero 2019
JAMA Intern Med. 4 de enero de 2019 ¿Cómo sabemos si un medicamento funciona? En los Estados Unidos, la Administración de Medicamentos y Alimentos de los Estados Unidos (FDA, por sus siglas en inglés) ha establecido una guía para informar el desarrollo de medicamentos, incluidas las pruebas para establecer la seguridad y eficacia de una indicación clínica específica, antes de la aprobación del mercado. Sin embargo, una vez aprobado, los médicos pueden recetar el medicamento para cualquier indicación clínica, no solo la que recibió la aprobación de la FDA. Esto se conoce como prescripción off-label.
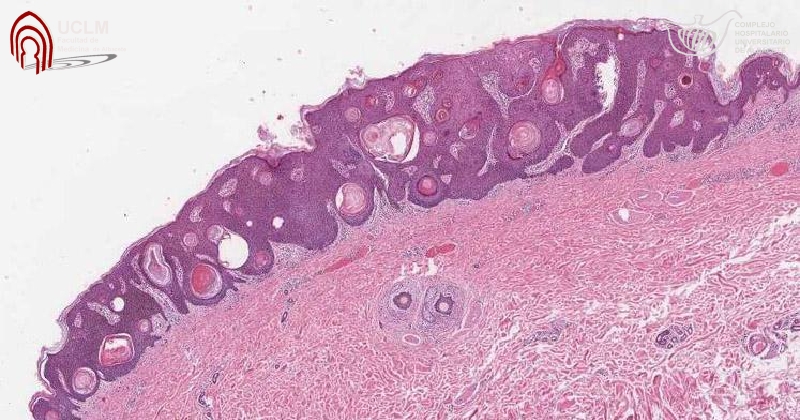
Peróxido de hidrógeno 40% (Eskata) para queratosis seborreicas
10 enero 2019
Jama , 8 de enero de 2019 La FDA ha aprobado una solución tópica de peróxido de hidrógeno al 40% (Eskata - Aclaris Therapeutics) para el tratamiento de las queratosis seborreicas elevadas (QS) en adultos. Es el primer fármaco aprobado para esta indicación. (El peróxido de hidrógeno está disponible sin receta para uso tópico como solución al 3%).

EE.UU. siguen retirando lotes de antihipertensivos por impurezas con potencial carcinógeno
07 enero 2019
