Farmacología

Comparación de consumo y precios de biosimilares en EE. UU., Alemania y Suiza
05 diciembre 2022
Los hallazgos de este estudio de cohorte sugieren que se han comercializado más biosimilares en Alemania y Suiza que en los EE. UU. Las políticas que contrarresten las prácticas anticompetitivas en los EE. UU. podrían permitir que los biosimilares ingresen al mercado antes y también podrían reducir los costos de atención médica con un mejor acceso. Se debe promover la concientización sobre los biosimilares para aumentar la aceptación de biosimilares a nivel mundial. JAMA Netw Open , 2 de diciembre de 2022

Cumplimiento de Compromisos y Requisitos de Postcomercialización de Nuevos Medicamentos Aprobados por la FDA, 2013-2016
28 octubre 2022
Los retrasos en la entrega de la información de seguridad y eficacia posterior a la aprobación necesaria para los medicamentos nuevos tienen implicaciones para la atención del paciente, en particular para las preguntas clínicas no resueltas y las poblaciones excluidas de los ensayos previos a la aprobación. Para abordar este problema, el Congreso debería considerar otorgar a la FDA más autoridad, como la capacidad de instituir sanciones monetarias civiles automáticas cuando los fabricantes de productos farmacéuticos no cumplan con sus requisitos y compromisos a tiempo. JAMA Intern Med. 3 de octubre de 2022
FDA permite que los medicamentos sin un beneficio clínico comprobado permanezcan durante años en la vía acelerada
30 julio 2021
"El proceso actual, que permite que los medicamentos estén en el mercado con una base de evidencia tan baja, envía señales equivocadas a otras compañías farmacéuticas, que asumirán que también pueden obtener aprobación con poca evidencia". BMJ 30 de julio de 2021
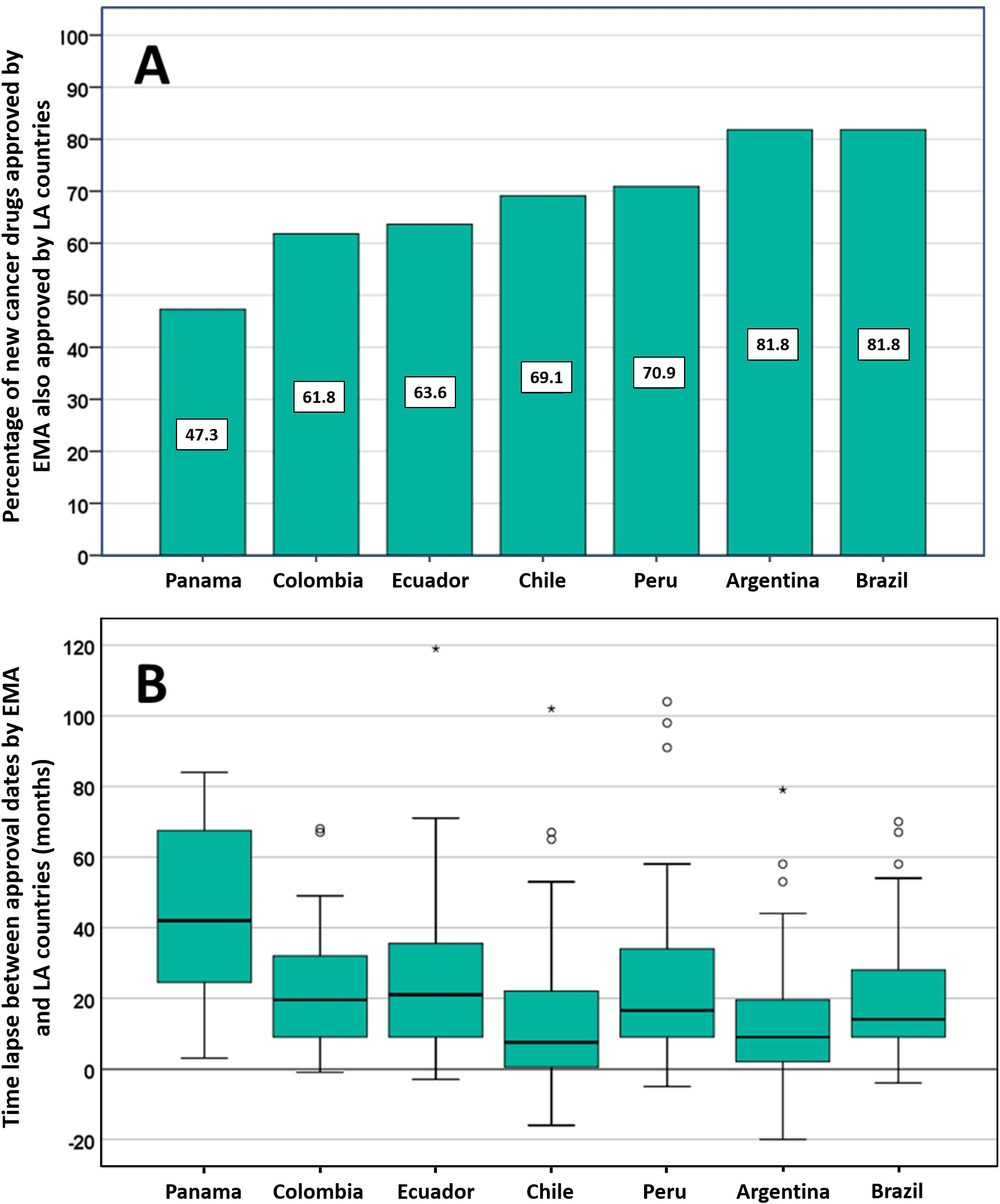
Posible impacto negativo de las decisiones de Agencias reguladoras reputadas sobre el estado de aprobación de nuevos medicamentos contra el cáncer en los países de América Latina
14 julio 2021
Los países de América Latina siguen aprobando nuevos medicamentos contra el cáncer, a menudo basándose en ensayos clínicos mal realizados que miden criterios de valoración sustitutos. La EMA y otros reguladores de renombre deben ser conscientes de que sus decisiones regulatorias pueden influir directamente en las decisiones relativas a la autorización de comercialización, los presupuestos de salud y la atención del paciente en otros lugares. PLoS ONE 13 de julio de 2021

Aducanumab y la necesidad de mostrar diferencias mínimas clínicamente importantes en los ensayos sobre la enfermedad de Alzheimer
11 junio 2021
