Farmacología

Un análisis empírico de la supervivencia general en las aprobaciones de medicamentos por parte de la FDA de EE. UU. (2006-2023).
30 abril 2024
Alrededor del 32% de todas los medicamentos oncológicos aprobados por la FDA entre 2006 y 2023 tienen evidencia de una mejora en la sobrevida general. Se necesitan estándares más altos en la regulación de medicamentos para garantizar que los medicamentos aprobados brinden mejores resultados para los pacientes, específicamente en lo que respecta a la supervivencia. Cancer Medicine, 1º de abril de 2024.
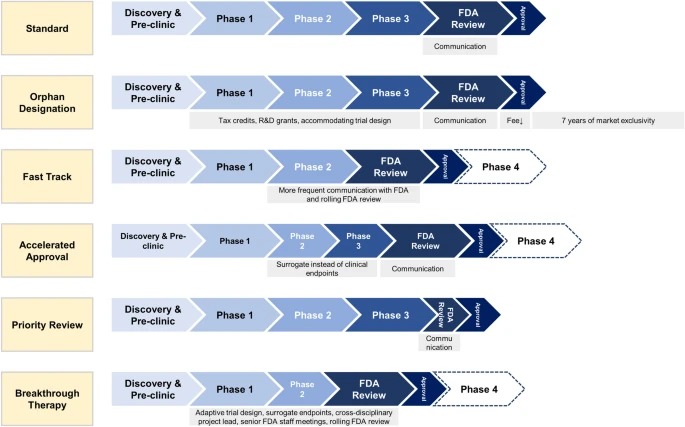
Designaciones especiales de la FDA para el desarrollo de medicamentos: huérfano, vía rápida, aprobación acelerada, revisión prioritaria y terapia innovadora
13 diciembre 2023
Las designaciones especiales de la FDA acortan los tiempos de desarrollo clínico y aprobación de la FDA para nuevos medicamentos que tratan enfermedades raras y graves con necesidades médicas no cubiertas. Los medicamentos especialmente designados ofrecen un mayor beneficio clínico a los pacientes. Sin embargo, los médicos, los pacientes y las aseguradoras deben ser conscientes de que los medicamentos designados especialmente a menudo se aprueban basándose en ensayos no sólidos, se asocian con más efectos secundarios no reconocidos y se venden a precios más altos. Eur J Health Econ, 14 noviembre 2023

Tiempo de revisión de los medicamentos oncológicos y sus factores subyacentes: una exploración en China
06 noviembre 2023
El breve retraso en el lanzamiento en relación con los EE. UU. fue un factor importante para la velocidad de revisión de la Administración Nacional de Productos Médicos de China, lo que podría sugerir su dependencia regulatoria latente del otro regulador global durante el período posterior a la comercialización, cuando aún faltaba nueva información sobre el beneficio clínico del medicamento. Front. Pharmacol., 1 de noviembre de 2023

Duración de la revisión regulatoria y diferencias en los tiempos de presentación de medicamentos en Estados Unidos y Europa, 2011 a 2020
17 octubre 2023
Sería beneficioso para los pacientes si se siguieran minimizando las diferencias en los tiempos de presentación entre Estados Unidos y Europa. Ann Intern Med. 17 de octubre de 2023

Aprobaciones de biosimilares por parte de trece autoridades reguladoras: una comparación transnacional
04 septiembre 2023
