Farmacología

FDA advierte sobre problemas graves con dosis altas del antialérgico difenhidramina (Benadryl). El abuso adolescente provocado por el peligroso "Desafío Benadryl" promovido en las redes sociales
28 septiembre 2020
La Administración de Medicamentos y Alimentos de los EE. UU. (FDA) advierte que tomar dosis más altas que las recomendadas del medicamento común para la alergia de venta libre (OTC) difenhidramina (Benadryl) puede provocar problemas cardíacos graves, convulsiones, coma o incluso la muerte. Se está al tanto de las noticias de adolescentes que terminan en las salas de emergencia o mueren después de participar en el “Desafío Benadryl” alentado en videos publicados en la aplicación de redes sociales TikTok. FDA, 24 de septiembre de 2020

FDA, Benzodiazepinas Actualización de la advertencia de recuadro para mejorar el uso seguro
25 septiembre 2020
FDA exige que se actualice la advertencia de recuadro , la advertencia más destacada de la FDA, agregando otra información a la información de prescripción de todos los medicamentos con benzodiazepinas. Esta información describirá los riesgos de abuso, uso indebido, adicción, dependencia física y reacciones de abstinencia de manera constante en todos los medicamentos de la clase. La FDA también requiere actualizaciones de las Guías de medicamentos para pacientes existentes para ayudar a educar a los pacientes y cuidadores sobre estos riesgos.FDA, 23 de septiembre de 2020
COVID-19: EE. UU. aprueba el uso de emergencia de plasma de convalecientes a pesar de las advertencias sobre la falta de pruebas
27 agosto 2020
Aunque los resultados observacionales son prometedores, en ausencia de estudios aleatorizados no es posible establecer si el plasma convaleciente funciona. British Medical Journal, 25 de agosto de 2020.
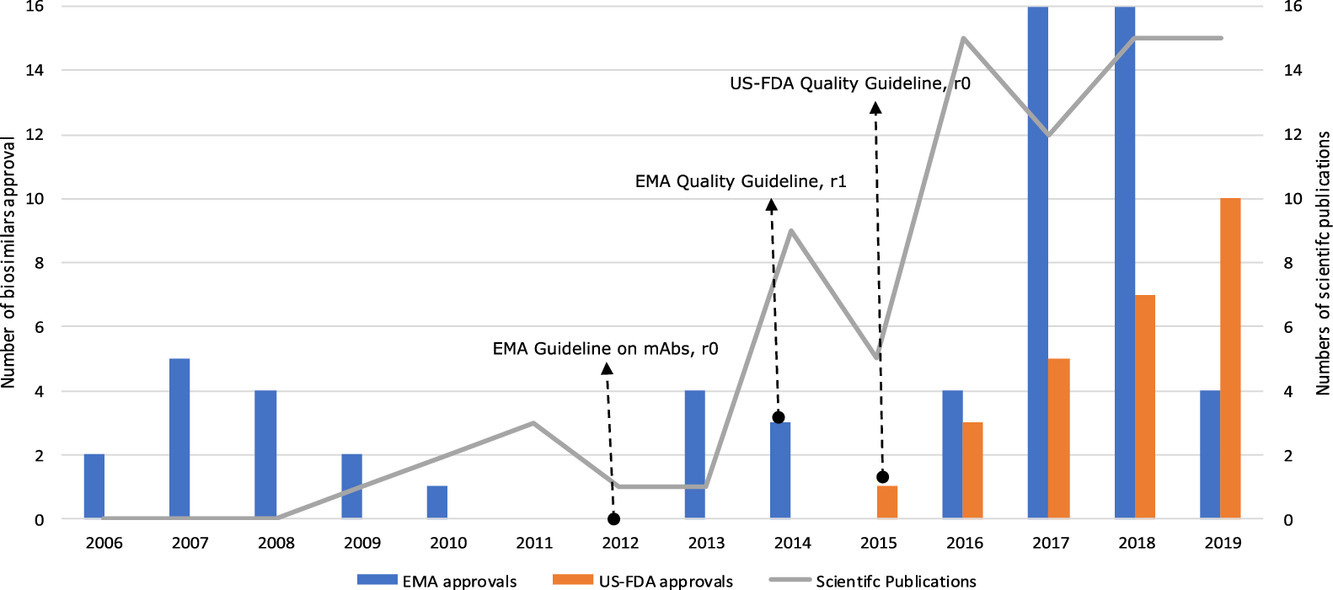
Informe de atributos de calidad en publicaciones científicas que presentan evaluaciones de biosimilaridad de biosimilares (previstos): una revisión sistemática de la literatura
31 julio 2020
Las evaluaciones de biosimilaridad de los atributos de calidad (QA) se han publicado en publicaciones científicas revisadas por pares para aproximadamente el 60% de los biosimilares aprobados. La dinámica de las publicaciones y los tipos de QA de informes aumentaron con el tiempo en paralelo con un mayor número de biosimilares con licencia y parece verse afectada por el desarrollo de pautas regulatorias en 2012-2015.La disponibilidad de una evaluación completa, públicamente accesible (acceso abierto) e imparcial de biosimilaridad de QA podría contribuir a una mayor confianza y aceptación de biosimilares en la práctica clínica. Eur J Pharm Sci, 30 de julio de 2020

Limitaciones en los ensayos clínicos que conducen a la aprobación de medicamentos contra el cáncer por parte de la FDA
17 junio 2020
