Farmacología
Riesgo de angioedema inducido por medicamentos: un estudio de farmacovigilancia de la base de datos del sistema de notificación de eventos adversos de la FDA
08 agosto 2024
Muchos medicamentos se asocian con un alto riesgo de angioedema. Estos medicamentos desempeñan un papel crucial y potencialmente prevenible en el control de la aparición de angioedema. Es fundamental tener en cuenta el nivel de riesgo de angioedema inducido por fármacos en la práctica clínica para optimizar el tratamiento farmacológico. Front Pharmacol. 16 de julio de 2024

Seguridad de los medicamentos para enfermedades cardiovasculares aprobados entre 2014 y 2021 en EE. UU.: un análisis de farmacovigilancia
22 mayo 2024
Este estudio identificó preocupaciones de seguridad específicas relacionadas con los medicamentos para enfermedades cardiovasculares aprobados recientemente. Se requiere más investigación para comprender los mecanismos subyacentes y las implicaciones clínicas de estos hallazgos. Expert Rev Cardiovasc Ther. 12 de mayo de 2024
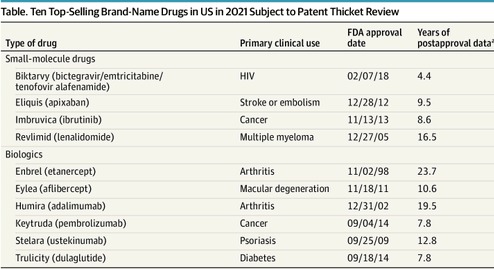
Carteras de patentes que protegen los 10 medicamentos de venta bajo receta más vendidos
14 mayo 2024
Este estudio encontró que de las 1429 patentes solicitadas para los 10 medicamentos recetados más vendidos en los EE. UU. en 2021, las presentadas después de la aprobación de la FDA (casi las tres cuartas partes) y que contenían reivindicaciones que cubrían aspectos distintos del ingrediente activo del medicamento contribuyeron a la maraña de patentes. Es necesario un examen minucioso de las solicitudes de patentes y de las patentes presentadas después de la aprobación de la FDA para facilitar la competencia oportuna de genéricos o biosimilares. JAMA Intern Med. 13 de mayo de 2024.

Un análisis empírico de la supervivencia general en las aprobaciones de medicamentos por parte de la FDA de EE. UU. (2006-2023).
30 abril 2024
Alrededor del 32% de todas los medicamentos oncológicos aprobados por la FDA entre 2006 y 2023 tienen evidencia de una mejora en la sobrevida general. Se necesitan estándares más altos en la regulación de medicamentos para garantizar que los medicamentos aprobados brinden mejores resultados para los pacientes, específicamente en lo que respecta a la supervivencia. Cancer Medicine, 1º de abril de 2024.

Aprobaciones de indicaciones de medicamentos contra el cáncer en China y Estados Unidos: una comparación de los tiempos de aprobación y el beneficio clínico, 2001-2020
10 abril 2024
