Farmacología

El laboratorio productor de aducanumab suspende su producción, a dos años de la controvertida aprobación acelerada de la FDA
07 febrero 2024
El anticuerpo monoclonal para el tratamiento de la enfermedad de Alzheimer se aprobó en base a resultados subrogados, sin pruebas de beneficio clínico, y con el desacuerdo de expertos de la propia FDA. Las principales coberturas de salud no lo incorporaron en sus formularios y el estudio confirmatorio que debe seguir a la aprobación acelerada fue discontinuado. Psychiatric Times, 30 de enero de 2024.

FDA: pensamientos o acciones suicidas en pacientes que toman cierto tipo de medicamentos aprobados para la diabetes tipo 2 y la obesidad
01 febrero 2024
Actualización sobre la evaluación en curso La evaluación preliminar no sugiere una relación causal. Comunicado de la FDA sobre la seguridad de los medicamentos, 11 de enero de 2024
Hipocalcemia grave con denosumab en pacientes femeninas mayores dependientes de diálisis
22 enero 2024
El denosumab se asoció con una incidencia notablemente mayor de hipocalcemia grave y muy grave en pacientes femeninas dependientes de diálisis de 65 años o más en comparación con los bifosfonatos orales. Dada la complejidad del diagnóstico de la fisiopatología ósea subyacente en pacientes dependientes de diálisis, el alto riesgo que plantea denosumab en esta población y las complejas estrategias necesarias para controlar y tratar la hipocalcemia grave, denosumab debe administrarse después de una cuidadosa selección de pacientes y con planes de seguimiento frecuente. JAMA. 19 de enero de 2024. ver también comunicado de la FDA, 19 de enero de 2024.
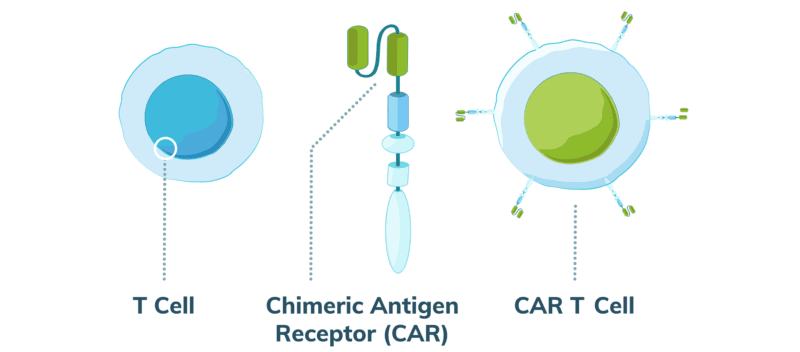
Linfoma de células T derivado de la terapia CAR-T: un nuevo alerta de seguridad
17 enero 2024
Varios pacientes sometidos a terapia con células T modificadas con un receptor de antígeno quimérico (CAR-T) para leucemia linfocítica aguda pediátrica, linfoma no Hodgkin y mieloma múltiple desarrollaron linfoma de células T. El linfoma en cuestión contiene el receptor de antígeno quimérico (CAR) utilizado, lo que significa que el medicamento en sí se ha convertido en una enfermedad maligna. La FDA continúa evaluando las implicancias del hallazgo. JAMA, 11 de enero de 2024.
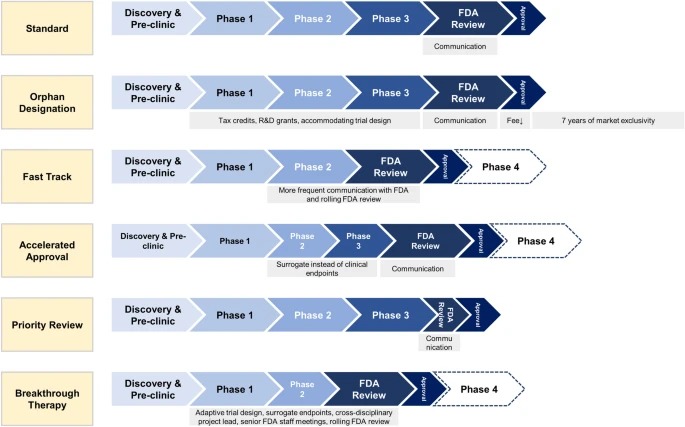
Designaciones especiales de la FDA para el desarrollo de medicamentos: huérfano, vía rápida, aprobación acelerada, revisión prioritaria y terapia innovadora
13 diciembre 2023
