Farmacología

FDA autoriza el primer tratamiento antiviral oral contra el COVID-19: Paxlovid (nirmatrelvir + ritonavir)
23 diciembre 2021
Autorizado para el tratamiento de la enfermedad del coronavirus (COVID-19) de leve a moderada, en adultos y pacientes pediátricos (de 12 años de edad o mayores que pesen al menos 40 kilogramos o cerca de 88 libras) con resultados positivos directamente de las pruebas de SARS-CoV-2 y que tiene un alto riesgo de enfermar gravemente de COVID-19, incluyendo hospitalización o la muerte. FDA, 22 de diciembre de 2021

La FDA autoriza una dosis de refuerzo de la vacuna contra el COVID-19 de Pfizer-BioNTech para determinadas poblaciones
24 septiembre 2021
La Administración de Alimentos y Medicamentos de los EE. UU. (FDA, por sus siglas en inglés) enmendó la autorización de uso de emergencia (EUA, por sus siglas en inglés) de la vacuna contra el COVID-19 de Pfizer-BioNTech para permitir el uso de una dosis única de refuerzo, que se administrará al menos seis meses después de completar la serie primaria con la vacuna contra el COVID-19 de Pfizer-BioNTech en: personas de 65 años o mayores, personas de 18 a 64 años de edad con alto riesgo de contraer COVID-19 grave; y personas de 18 a 64 años de edad cuya exposición institucional u ocupacional frecuente al SARS-CoV-2 los pone en alto riesgo de complicaciones graves por COVID-19, incluyendo COVID-19 de gravedad. FDA, 22 de septiembre de 2021

¿Deberían las autoridades reguladoras aprobar medicamentos basados en desenlaces subrogados?
17 septiembre 2021
La controversia del aducanumab es el último ejemplo de criterios de valoración sustitutos que no predicen resultados clínicamente importantes. Sin embargo, como informan Jeanne Lenzer y Shannon Brownlee, se utilizan cada vez más como la base para las aprobaciones de medicamentos. BMJ 16 de septiembre de 2021
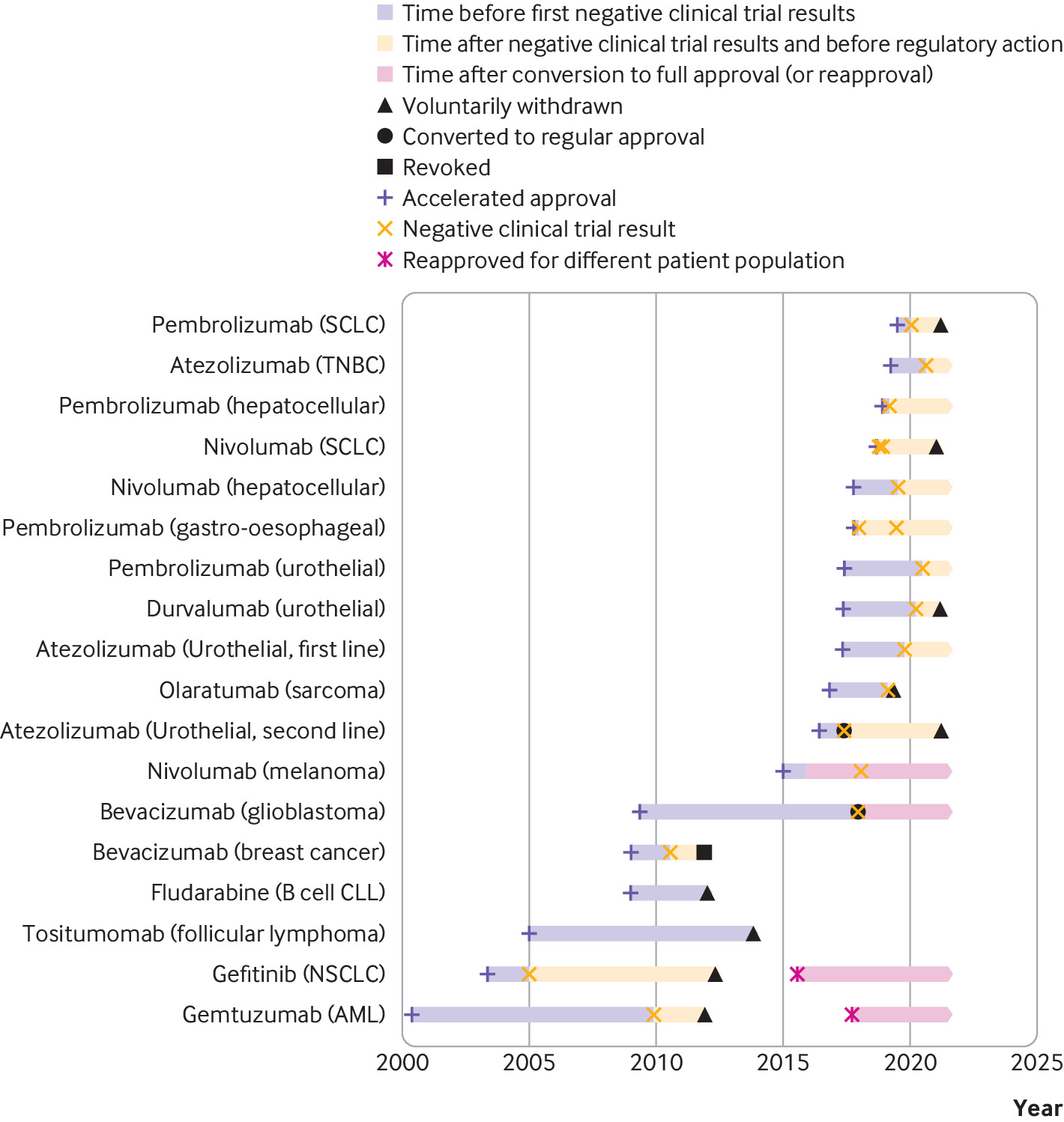
Consecuencias regulatorias y clínicas de los ensayos confirmatorios negativos de medicamentos contra el cáncer de aprobación acelerada
13 septiembre 2021
Las indicaciones de medicamentos contra el cáncer que recibieron una aprobación acelerada a menudo permanecieron en el etiquetado formal de medicamentos aprobados por la FDA y continuaron recomendándose en las guías clínicas varios años después de que los ensayos posteriores a la aprobación requeridos por ley no mostraran una mejoría en el criterio de valoración de eficacia primario. Las guías clínicas deben alinearse mejor con los resultados de los ensayos posteriores a la aprobación de medicamentos contra el cáncer que recibieron una aprobación acelerada. BMJ, 9 de septiembre de 2021
FDA permite que los medicamentos sin un beneficio clínico comprobado permanezcan durante años en la vía acelerada
30 julio 2021
