Farmacología

Críticas a la aprobación acelerada por la FDA de un medicamento para el Alzheimer
19 julio 2021
El aducanumab se aprobó por su efecto sobre las placas de amiloide cerebral, sin verificar si el tratamiento es beneficioso para los pacientes. Se plantea que este aspecto crucial recién se evaluará en investigaciones posteriores a la comercialización. La vía de aprobación acelerada de la FDA se ve seriamente cuestionada. JAMA Internal Medicine, 13 de julio de 2021
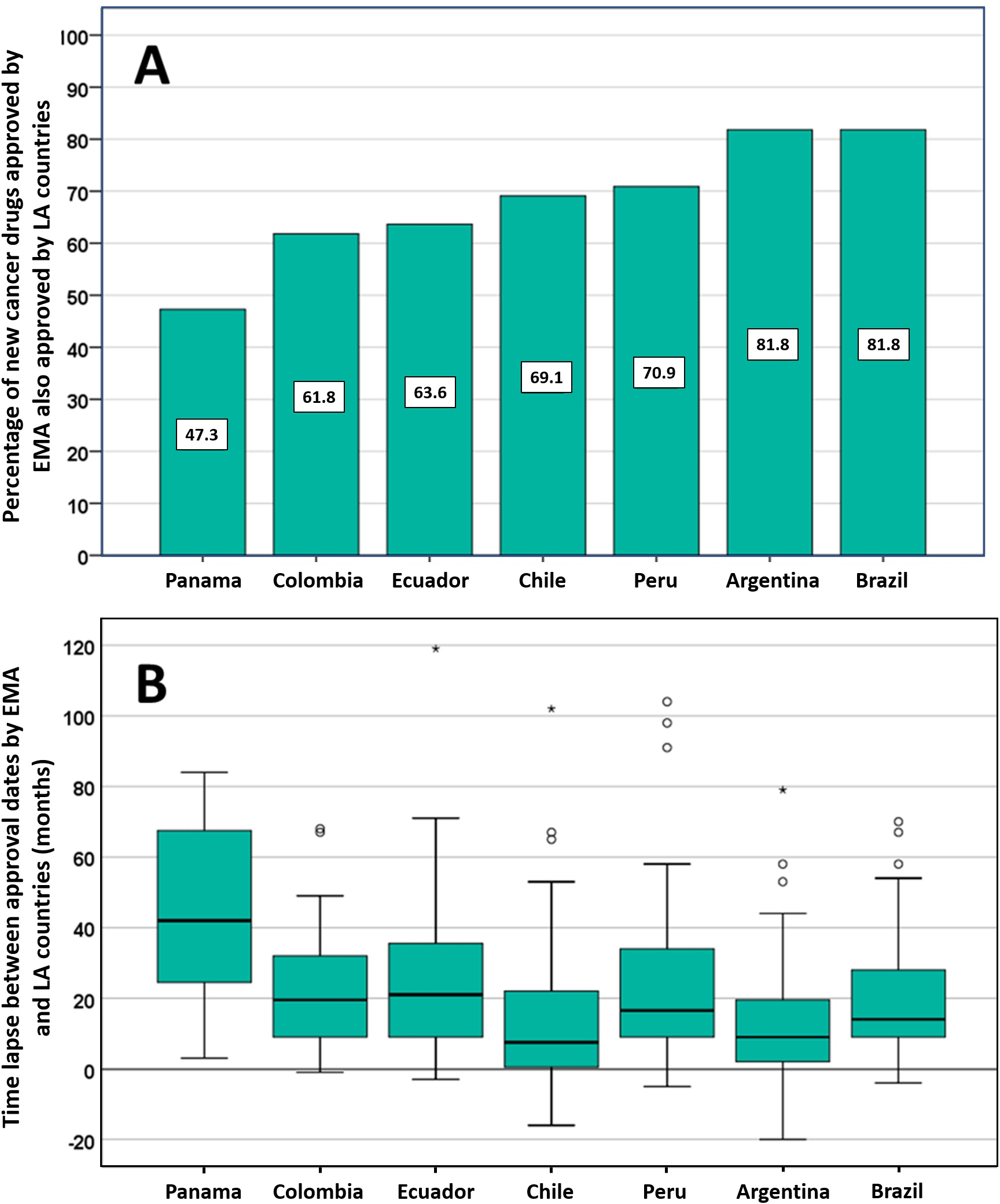
Posible impacto negativo de las decisiones de Agencias reguladoras reputadas sobre el estado de aprobación de nuevos medicamentos contra el cáncer en los países de América Latina
14 julio 2021
Los países de América Latina siguen aprobando nuevos medicamentos contra el cáncer, a menudo basándose en ensayos clínicos mal realizados que miden criterios de valoración sustitutos. La EMA y otros reguladores de renombre deben ser conscientes de que sus decisiones regulatorias pueden influir directamente en las decisiones relativas a la autorización de comercialización, los presupuestos de salud y la atención del paciente en otros lugares. PLoS ONE 13 de julio de 2021
Evaluación de nuevas entidades moleculares aprobadas para el tratamiento del cáncer en 2020
02 junio 2021
La FDA aprobó más nuevas entidades moleculares (NEM) para el cáncer en 2020 que en 2019. Sin embargo, la mayoría de las NEM aprobadas se basaron en criterios de valoración sustitutos con efectos inciertos sobre la supervivencia y la calidad de vida.5 La mayoría de las aprobaciones se basaron en ensayos clínicos no controlados de un solo brazo y requerirán pruebas de eficacia posteriores a la comercialización. JAMA Netw Open, 28 de mayo de 2021

FDA desaconseja las pruebas de anticuerpos para evaluar la inmunidad después de la vacunación contra COVID-19
28 mayo 2021
Las vacunas autorizadas para la prevención de COVID-19 inducen anticuerpos contra dianas proteicas virales específicas (spike); Los resultados de la prueba de anticuerpos posteriores a la vacunación serán negativos en personas sin antecedentes de infección natural previa si la prueba utilizada no detecta el tipo de anticuerpos inducidos por la vacuna. FDA, 19 de mayo de 2021
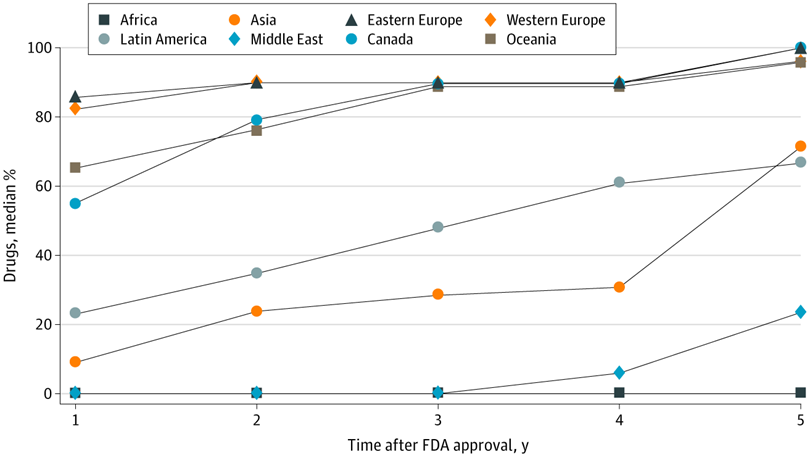
Evaluación de ensayos de medicamentos en países de ingresos altos, medianos y bajos y disponibilidad comercial local de medicamentos recientemente aprobados
17 mayo 2021
