Farmacología
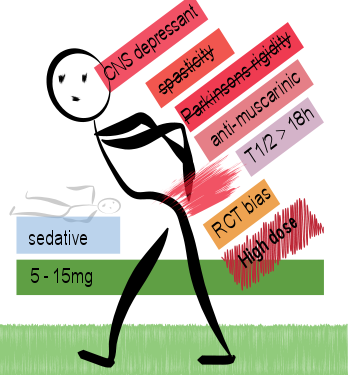
¿Es útil la ciclobenzaprina para el dolor?
31 julio 2017
Therapeutics Letter [105] , 24 de julio de 2017 la ciclobenzaprina se prescribe para el dolor agudo en dosis más altas y por períodos más largos que los necesarios, y se prescribe con frecuencia para su uso no aprobado a largo plazo. No hay pruebas convincentes de que la ciclobenzaprina sea un relajante muscular. Los efectos sobre el dolor o la función general son probablemente resultado de la sedación.

Ezetimiba / Atorvastatina: No supone un avance terapéutico
14 julio 2017
Ficha Eval Medicam, Año 2017 - Número 8, CADIME, 13 de julio de 2017 Tres estudios mostraron la bioequivalencia de ezetimiba/atorvastina con la administración concomitante de los dos fármacos en comprimidos separados. No se ha demostrado que la administración de la asociación de ezetimiba/atorvastatina a dosis fijas mejore el cumplimiento del tratamiento. No supone un avance terapéutico en el tratamiento de la hipercolesterolemia

Prescripciones verbales y errores de medicación
14 julio 2017
ISMP-España Boletín nº 44 (Julio 2017) Las prescripciones verbales se siguen utilizando todavía en la práctica asistencial en situaciones específicas en que no resulta posible realizar una prescripción electrónica o manual, en particular en unidades de cuidados intensivos, ambulancias, servicios de urgencias y quirófanos.

Metilprednisolona inyectable con lactosa de origen bovino como excipiente: no administrar a pacientes alérgicos a las proteínas de la leche de vaca
11 julio 2017
AEMPS, 7 de julio de 2017 En pacientes alérgicos a las proteínas de la leche de vaca pueden aparecer reacciones alérgicas graves tras la administración parenteral de preparados de metilprednisolona que contienen lactosa de origen bovino para el tratamiento de cuadros alérgicos agudos.

Fármacos que prolongan el intervalo QT
06 julio 2017
