Farmacología

WHO Drug Information Vol. 33, No. 3, 2019
06 enero 2020
OMS, diciembre de 2019se brinda un resumen de varios documentos de consulta (en inglés)

Alergia a las proteínas de la leche de vaca.
03 enero 2020
Boletín BOLCAN vol 11, núm 2Servicio Canario de la Salud, diciembre de 2019No todas las reacciones adversas relacionadas con las proteínas de leche de vaca (PLV) tienen una naturaleza alérgica, y deben diferenciarse de aquéllas que se producen por otros mecanismos para evitar diagnósticos erróneos, dietas restrictivas y costos innecesarios.

Errores de medicación en fórmulas magistrales.
03 enero 2020
Se ha considerado oportuno efectuar una revisión de las principales fuentes de errores de (EM) en el ámbito de las formulas magistrales (FM). El texto también incluye ejemplos reales de EM en dicho ámbito que se han producido en nuestro entorno sanitario. Así pues, este boletín pretende difundir a los profesionales sanitarios información sobre la prevención de EM con las FM y, en definitiva, contribuir a un uso seguro de los fármacos. CatSalut, diciembre de 2019
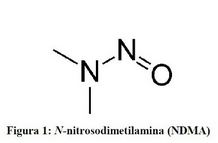
Actualización sobre las impurezas de nitrosaminas
02 enero 2020
OMS, 20 de noviembre de 2019 En julio de 2018, las autoridades sanitarias tomaron conocimiento por primera vez de la presencia de N-nitrosodimetilamina (NDMA), una impureza de nitrosamina, en productos que contenían valsartán. Este fármaco es un antagonista de los receptores de angiotensina II que pertenece a una familia de compuestos análogos denominados comúnmente sartanes. También se ha notificado también la presencia de ese tipo de impurezas en medicamentos que contienen pioglitazona y ranitidina

FDA advierte sobre problemas respiratorios graves con medicamentos para las convulsiones y el dolor nervioso: gabapentina (Neurontin, Gralise, Horizant) y pregabalina (Lyrica, Lyrica CR)
02 enero 2020
