Farmacología

Todas las investigaciones que involucran seres humanos requieren aprobación ética
17 enero 2024
Un editorial reciente de los Archivos Argentinos de Pediatría nos recuerda que los comités de ética en investigación (CEI) son los organismos en los que la sociedad descansa la responsabilidad de velar por los intereses de los participantes en investigaciones. Llama la atención que se siga discutiendo sobre la necesidad o no de someter a la evaluación de un CEI un proyecto de investigación antes de llevarlo a cabo. Archivos Argentinos de Pediatría, diciembre de 2023.

Las estrategias de búsqueda de revisiones sistemáticas están mal informadas y no son reproducibles
05 diciembre 2023
Este estudio de metainvestigación transversal encontró que los informes de búsqueda de reseñas sistemáticas son deficientes. Para corregir esto se necesitará una respuesta multifacética por parte de los autores, revisores pares, editores de revistas y proveedores de bases de datos. Journal of Clinical Epidemiology, 3 de diciembre de 2023
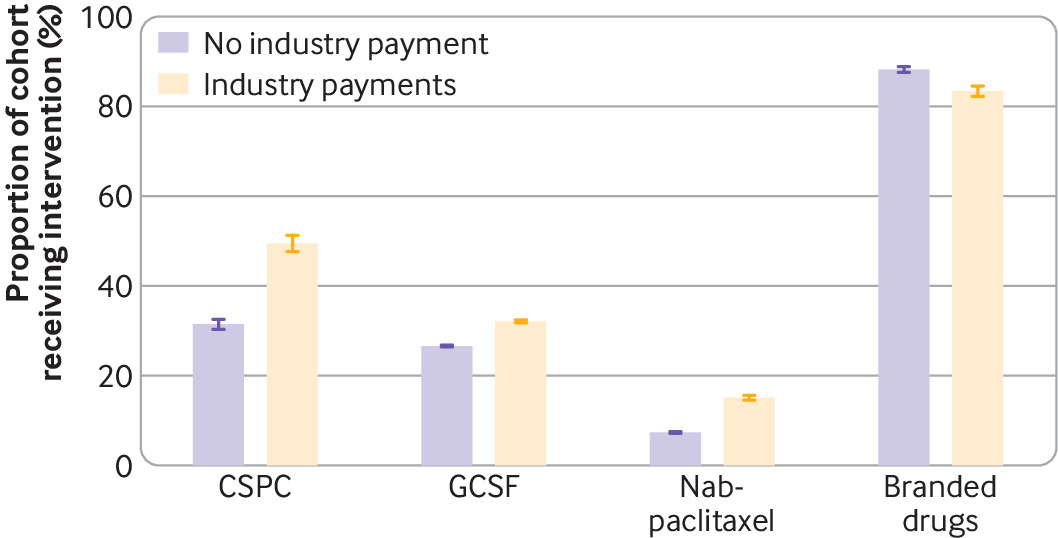
Pagos de la industria farmacéutica y entrega de medicamentos contra el cáncer no recomendados y de bajo valor
30 octubre 2023
Este estudio de cohorte de base poblacional. encontró que en algunos escenarios clínicos, los pagos de la industria a los médicos se asocian con medicamentos no recomendados y de bajo valor. Estos hallazgos plantean preocupaciones sobre la calidad de la atención sobre las relaciones financieras entre los médicos y la industria. BMJ 25 de octubre de 2023

Buenos Aires promulga la Ley Provincial Nº 15.462 sobre investigación en Salud Humana
26 octubre 2023
La Ley será de aplicación en los subsectores público, privado y de la seguridad social pertenecientes al sector de Salud de la Provincia de Buenos Aires, y tiene por objetivo salvaguardar los derechos y la dignidad de las personas en investigación, como así también, regular la actividad de la investigación en salud. Boletín Oficial de la Provincia de Buenos Aires, 24 de octubre de 2023.

Globalización de ensayos clínicos patrocinados por la industria para la investigación del cáncer de mama, pulmón y colon: tendencias, amenazas y oportunidades
03 octubre 2023
