Farmacología

¿Cómo responde USTED ante los Conflictos de Interés?
30 mayo 2022
El patrocinio de la industria farmacéutica de los ensayos clínicos puede conducir a conclusiones sesgadas, incluyendo afirmaciones exageradas sobre la eficacia y subestimación de los daños. Therapeutics Initiative 19 de mayo de 2022
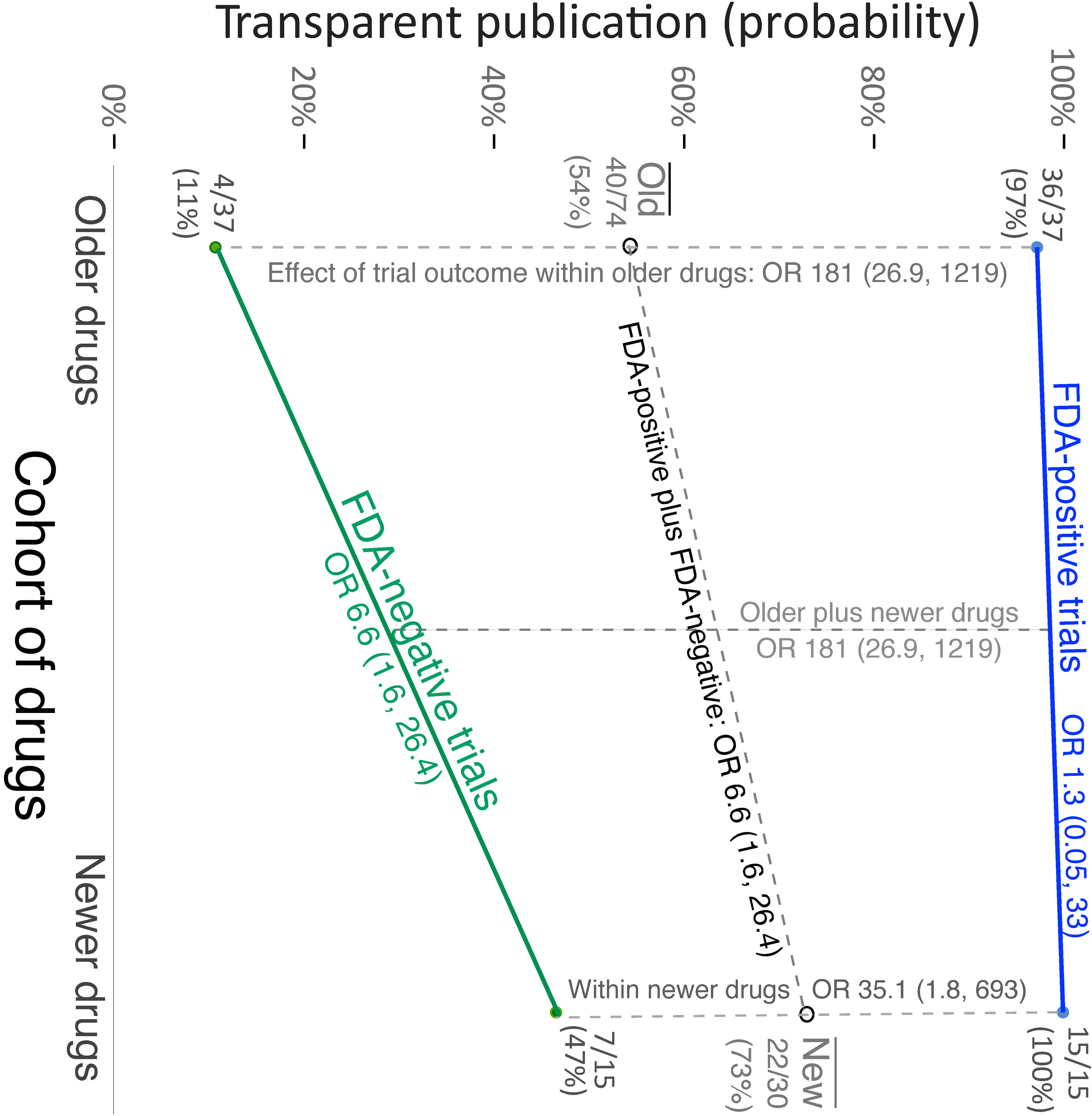
Publicación selectiva de ensayos de antidepresivos y su influencia en la eficacia aparente
28 enero 2022
En un estudio anterior, usando documentos de revisión de la Administración de Alimentos y Medicamentos (FDA) como estándar de oro, encontramos que muchos ensayos negativos habían sido mal informados en la literatura publicada como resultados positivos o simplemente no habían sido publicados. Este estudio encontró que el sesgo de notificación persiste, pero parece haber disminuido para los antidepresivos más nuevos, en comparación con los más antiguos. Se necesitan esfuerzos continuos para mejorar aún más la transparencia en la literatura científica. PLoS Med, 19 de enero de 2022
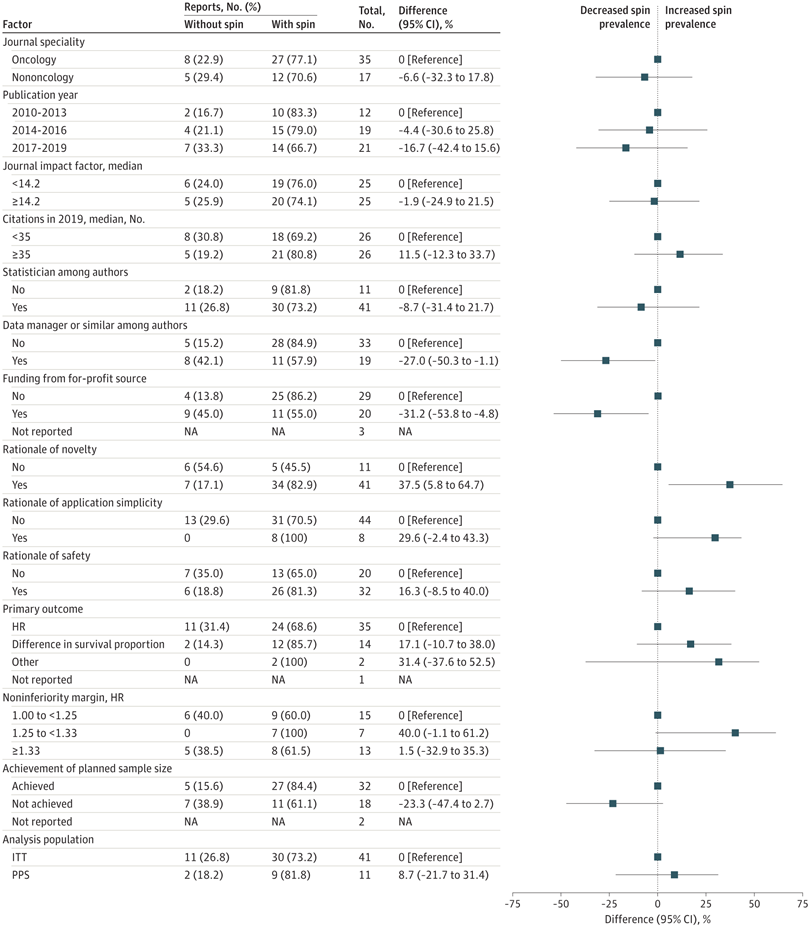
Informes engañosos en ensayos clínicos aleatorizados de no inferioridad en oncología con resultados estadísticamente no significativos
16 diciembre 2021
En esta revisión sistemática, la mayoría de los ECA de no inferioridad que informaron resultados que no fueron estadísticamente significativos para los puntos finales primarios mostraron una interpretación distorsionada y un informe inexacto. La novedad de un tratamiento experimental y el financiamiento solo de fuentes sin fines de lucro se asociaron con spin. Los autores deben considerar cuidadosamente la interpretación y el informe de los resultados de los ensayos clínicos de cáncer de no inferioridad, especialmente para los resultados de los resultados primarios que no son estadísticamente significativos.JAMA Netw Open7 de diciembre de 2021
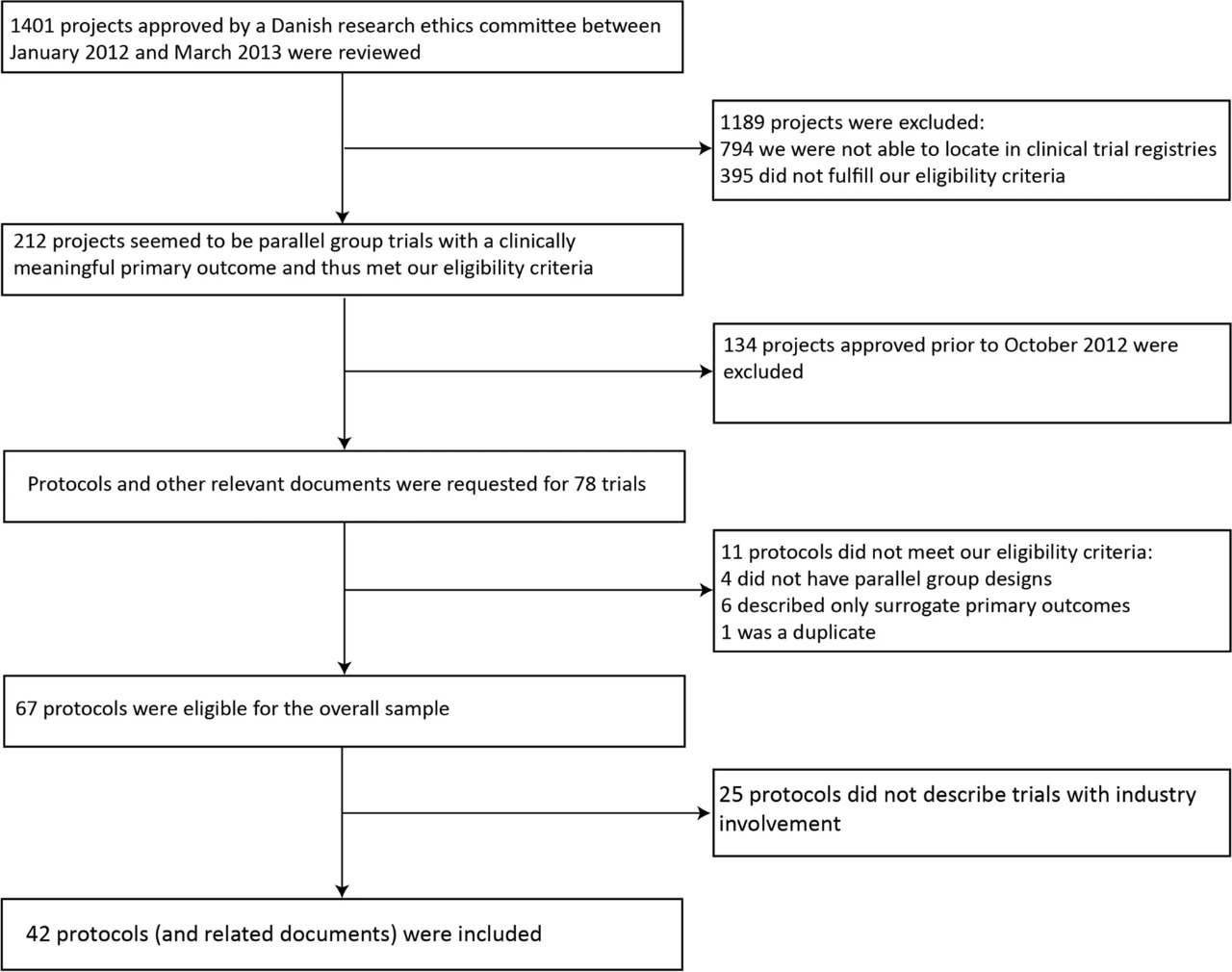
¿Se restringe el acceso de los investigadores a los datos de los ensayos clínicos y los derechos de publicación? ¿Se informa a los posibles participantes del ensayo sobre esto? Comparación de los protocolos de los ensayos y los materiales de consentimiento informado
30 septiembre 2021
Las restricciones de publicación son comunes y los datos suelen ser propiedad de socios de la industria. Esto rara vez se comunica a los participantes del ensayo. Tales limitaciones pueden contribuir a problemas con la notificación selectiva de resultados. Los pacientes deben estar completamente informados sobre estos aspectos de la realización del ensayo. BMC Medical Ethics 28 de agosto de 2021

Transparencia de los ensayos clínicos e intercambio de datos entre las empresas biofarmacéuticas y papel del tamaño de la empresa, ubicación y tipo de producto: un análisis descriptivo transversal
03 agosto 2021
